李浩同学用下图装置来测定空气中氧气的含量,对该实验认识正确的是( )
| A.使用红磷的量多或少,都不会影响实验的结果 |
| B.燃烧足量的红磷可使进入容器的水占其容积的五分之四 |
| C.红磷燃烧消耗空气中的氧气,使容器内压强减小,水面上升 |
| D.红磷一烧完,就要立刻观察,并记录进入容器的刻度 |
某兴趣小组发现某块土地玉米长势不好,为探究其原因,开启了项目学习之旅。
[查阅资料]玉米适宜在pH为6.0~7.0的土壤中生长;植物生长需要多种营养元素,包括碳、氢、氧、氮、磷、钾、钙、镁等大量元素和其他微量元素。
[任务一]检测土壤的酸碱度并制定改良方案
(1)检测该地土壤的酸碱度
可选用的实验用品:精密pH试纸(可精确到0.1)、标准比色卡、pH计、其他自选
实验步骤 |
测量结果 |
实验结论 |
步骤一:将3份不同位置的土样,干燥后分别与自来水按2:5的质量比在不同的烧杯中混合,充分搅拌后静置; |
试样一:pH=4.2 试样二:pH=4.4 试样三:pH=4.5 |
该土壤pH<6.0,不适合玉米生长 |
步骤二: 。 |
反思与评价:该实验方法有一处不够严密,请指出并说明原因 。
(2)探究熟石灰对土样酸碱性的改变情况
实验方法:取300g土样和 g蒸馏水混合,向其中加入一定量熟石灰,充分搅拌后静置,用pH计测定清液的pH;
测量结果:清液的pH为12.1;
反思:若要使改良的土壤适合玉米生长,需控制加入熟石灰的量。
(3)熟石灰用量的测定
实验目的:研究使300g土样呈中性所需的熟石灰的质量
实验方法: 。
(4)查阅资料,常用的酸性土壤改良剂有:生石灰、熟石灰、草木灰(主要成分K2CO3)、含钙的贝壳灰 (主要成分CaCO3) ; 要使改良后土壤的pH约为7,也可加入稍过量的 (从上述改良剂中选择)。
[任务二]分析土壤肥力
通过观察,该土地上玉米叶色略有发黄,且有倒伏现象;该小组同学建议施加适量含氮元素和钾元素的复合肥,如 。
用来测定空气成分的方法很多, 图1所示的是小明用红磷在空气中燃烧的测定方法。请回答下列问题:
⑴红磷燃烧一段时间后,自动熄灭了,你认为原因是 ;
⑵冷却后,松开止水夹,你观察到的现象为 。
⑶实验完毕,若进入集气瓶中水的体积偏低,你认为导致这一结果的原因可能是 。
⑷某同学对实验进行反思后,提出了改进方法(如图2所示),按右图组装仪器,关闭止水夹,通电使红磷燃烧。你认为改进后的优点是: 。
⑸上面的实验同时证明了氮气有 的化学性质。
下列图象与对应实验完全吻合的是()

| A. | ①往一定量的盐酸中滴加 溶液至过量 |
| B. | ②将一定量的不饱和 溶液恒温蒸发水 |
| C. | ③向一定量 溶液和稀硫酸的混合溶液中滴加 溶液 |
| D. | ④用两份等质量等溶质质量分数的过氧化氢溶液制取氧气(甲加少量 ) |
如图所示,将水分别滴人装有氢氧化钠固体和硝酸铵固体的两支试管中,下列说法错误的是()

| A. |
硝酸铵固体溶解时会吸收热量 |
| B. |
氢氧化钠固体溶解时会放出热量 |
| C. |
两只烧杯的溶液中都有固体析出 |
| D. |
两只烧杯中溶液的溶质质量分数都保持不变 |
某科学兴趣小组查阅资料得知镁可在氮气中燃烧生成氮化镁,设计了如下实验方案进行验证。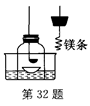
步骤1:用盛水的水槽、无底的废广口瓶、燃烧匙、蒸发皿、橡皮塞等装配成如图所示的装置。另准备一只有一根钢丝穿过的橡皮塞,钢丝末端固定一根镁条。
步骤2:引燃燃烧匙中足量的红磷,塞好橡皮塞。待充分冷却,观察到广口瓶内水面上升的体积约占瓶内水面原上方空间的1/5左右。
步骤3:往水槽中加水使广口瓶内外水面水平。点燃镁条,更换橡皮塞,镁条在广口瓶内继续燃烧,发出红光,放出热量。待冷却后广口瓶内水位继续上升。
(1)步骤2的目的是________________________________________________________。
(2)步骤3“待冷却后广口瓶内水位继续上升”,是由于瓶内气压_______(填“大于”、“小于”或“等于”)外界气压。
(3)根据上述实验和你所学的知识,请写出镁在空气中燃烧时的符号表达式:_______
______________________________________________________________________。
下图所示装置可用于测定空气中氧气的含量,实验前在集气瓶内加入少量水,并做上记号。下列说法中不正确的是

| A. |
集气瓶内加入少量水可防止瓶底炸裂 |
| B. |
该实验所用红磷的量不足可能造成气体减少的体积小于五分之一 |
| C. |
实验时,点燃的红磷要立即伸入集气瓶中,并塞紧橡皮塞 |
| D. |
红磷燃烧产生大量的白雾,火焰熄灭后立刻打开弹簧夹 |
空气是一种重要的自然资源,请回答下列问题。
(1)近年来,大气中二氧化碳含量不断上升,带来的环境问题是。自然界中消耗二氧化碳的途径是。科学家正在研究将过多的二氧化碳和氢气在催化剂和加热的条件下反应,转化为水和甲烷。这个反应的化学方程式为。
(2)铁与空气中的等物质发生复杂的化学反应,生成铁锈,影响金属材料的有效利用。找出一种铁制品并说明它是怎样防锈的。铁制品一旦生锈,可以用稀盐酸除锈。除锈时观察到的现象,写出反应的化学方程式。
下列说法合理的有( )
①高炉炼铁炼得的是纯铁
②打开汽水瓶盖,看到气泡逸出,说明气体的溶解度随压强的减小而减小
③向充满CO 2气体的软塑料瓶中倒入半瓶水,拧紧瓶盖,振荡,塑料瓶变瘪,说明CO 2能与水发生反应
④某同学将一定量的Na 2CO 3和Ba(OH) 2溶液混合,要想检验反应后Ba(OH) 2是否过量,选用Na 2CO 3溶液、Na 2SO 4溶液或FeCl 3溶液均可
⑤向一定量的NaCl、MgSO 4和HCl的混合溶液中逐滴加入NaOH溶液,如图表示加入NaOH溶液的质量与某些物质的质量变化关系。则m点对应的溶液中有三种溶质,a可表示NaCl或H 2O的质量变化情况

| A. |
1个 |
B. |
2个 |
C. |
3个 |
D. |
4个 |
常温下没有氧气存在时,铁与水几乎不反应,但高温下,铁与水蒸气能反应生成一种常见铁的氧化物和一种气体。小明很好奇,设计如下实验探究铁粉与水蒸气反应后的产物。
(1)试管尾部放一团湿棉花的目的是_______________。
(2)探究生成的气体是什么?
用燃着的木条靠近肥皂泡,有爆鸣声,稍后有肥皂泡飘到空中。说明生成的气体是______________。
(3)探究试管中剩余固体成分是什么?
【查阅资料】
| 常见铁的氧化物 |
FeO |
Fe2O3 |
Fe3O4 |
| 颜色、状态 |
黑色粉末 |
红棕色粉末 |
黑色晶体 |
| 能否被磁铁吸引 |
否 |
否 |
能 |
【初步验证】试管中剩余固体为黑色,能全部被磁铁吸引。
【猜想与假设】猜想一:剩余固体是Fe与Fe3O4;猜想二:剩余固体是_____________
【实验探究】
| 实验操作 |
实验现象及结论 |
| |
|
【实验结论】铁和水蒸气反应的化学方程式为_________________________________。
【反思与交流】该黑色固体不可能是Fe2O3,理由是___________________________。
如下图所示,将足量的某铁粉用水均匀地粘在试管内壁上,将试管倒立在装有水
的烧杯中。实验过程中,观察到试管内液面缓慢上升。下列分析错误的是( )

| A. | 水能进入试管的最大体积约为试管容积的1/5 |
| B. | 该铁粉在试管内发生了氧化反应 |
| C. | 这一实验可以验证空气的组成不是单一的 |
| D. | 如把该铁粉改为木炭粉,两者的现象完全相同 |
为了测定空气中氧气的体积分数,按右图装置进行实验:
(1)将 燃烧匙中的过量的红磷点燃后放入集气瓶中,观察到的现象是
燃烧匙中的过量的红磷点燃后放入集气瓶中,观察到的现象是
_______________________________________ ____;
____;
(2)待反应停止冷却后打开止水夹,烧杯中的水会进入集气瓶,大约达到集气瓶体积的_______为止,有时没有达到理论值的原因_______________________(只要写一点)
(3)燃烧匙内为什么要盛放过量的红磷?______________ 。
。
(4)这个实验除了可以得出氧气约占空气体积的一定体积分数的结论外,还可以推出氮
______(填“易”或“难”)溶于水和其化学性质_______(填“活泼”或“不活泼”)的结
论。
( 5)写出发生该反应的文字表达式____________________________。
5)写出发生该反应的文字表达式____________________________。
(6)已知:镁+氧气 氧化镁(固体),镁+氮气
氧化镁(固体),镁+氮气 氮化镁(固体)。根据上述反应,想一想,能否用镁代替红磷来测定空气的组成?_______(填“能”或“不能”),为什么?___________________________________。
氮化镁(固体)。根据上述反应,想一想,能否用镁代替红磷来测定空气的组成?_______(填“能”或“不能”),为什么?___________________________________。
有一部分变质的KOH样品,含有杂质K2CO3和H2O.取一定量该样品,溶于100克质量分数为18.25%的盐酸中充分反应后,再加入一定质量质量分数为10%的KOH溶液反应至中性。问:
(1)当样品与100克质量分数为18.25%的盐酸充分反应后,此时溶液pH 7(填“>”、“<”、或“﹦”)。
(2)把反应后的溶液蒸干后可得到的固体是 (填名称)。
(3)把反应后的溶液蒸干后可得到固体的质量是多少克?(写出简要的计算过程,计算结果精确到0.01)
试题篮
()