四氧化三铁是一种常用的磁性材料,由工业废料铁泥(含Fe、Fe2O3、FeO和杂质,杂质不参与反应)制取Fe3O4的一种流程如图:
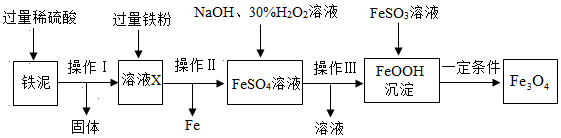
(1)操作Ⅱ的名称是 。
(2)Fe2O3与稀硫酸反应的化学方程式为 ,为使铁泥与稀硫酸充分反应,可采取的措施是 (答出一点即可)。
(3)向溶液X中加入过量铁粉的作用是 。
(4)FeOOH与FeSO3溶液在一定条件下反应生成Fe3O4和 (填化学式)。
硝酸钙可用于无土栽培等。一种利用石灰石制备硝酸钙晶体的流程如图:
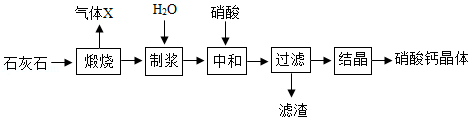
已知:硝酸会挥发、受热会分解。
(1)气体X为 (填化学式)。
(2)“制浆”所得的混合物属于 (填字母)。
a.溶液 b.悬浊液 c.乳浊液
(3)写出“中和”步骤主要反应的化学方程式: 。
(4)工业生产根据以下两项指标判断“中和”反应完全发生:容器内混合物基本变澄清和 。
(5)“制浆”时须控制好加入水的量。加入水量太少会导致制浆困难;加入水量太多会导致 。
(6)若省去“制浆”步骤也可制得硝酸钙。但硝酸利用率会降低,同时会产生污染气体NOx.产生NOx的原因是 。
波尔多液含氢氧化钙、氢氧化铜和硫酸钙等物质,是农业上常用的杀菌剂。一种生产波尔多液的工艺流程如图。
(1)“煅烧”的化学方程式为CaCO3 CaO+CO2↑,该反应属于基本反应类型中的 反应。
(2)“混合”时不能用铁制容器,原因是 。
(3)“混合”时需不断搅拌,目的是 。
(4)“混合”过程中硫酸铜和氢氧化钙反应生成氢氧化铜的化学方程式为 。
(5)“混合”后得到的波尔多液温度明显高于室温,原因是 。
(6)用 可以测定波尔多液酸碱度。

中国古代四大发明之一的"黑火药"是由木炭(C)、硫粉(S)和硝酸钾(KNO 3)按一定比例混合而成。
(1)分类。下列关于"黑火药"说法正确的是 。
a."黑火药"由"黑火药分子"构成
b."黑火药"中的KNO 3属于复合肥料
c."黑火药"中的C、S不再保持各自的化学性质
(2)变化。"黑火药"爆炸时发生的主要反应是:S+2KNO 3+3C═K 2S+N 2↑+3 ↑。
①依据质量守恒定律,空格上缺少的物质是 (填化学式)。
②"黑火药"爆炸时能闻到刺鼻的火药味,是因为爆炸时除了有硫化物,还有硫的氧化物生成。硫在空气中燃烧的化学方程式为 。
(3)制备。古代曾用硝土(含有Ca(NO 3) 2、少量NaCl等)和草木灰(含有K 2CO 3)作原料制取KNO 3.某化学兴趣小组设计了如图实验流程:
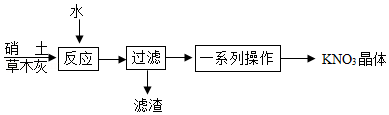
①"反应"过程中的化学方程式为 。
②"过滤"操作必须用到的玻璃仪器有烧杯、玻璃棒和 。
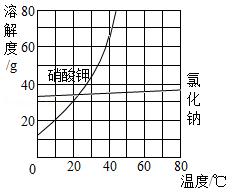
③如图是硝酸钾和氯化钠的溶解度曲线。"一系列操作"包括"加热蒸发浓缩、再冷却到一定温度、过滤"等步骤。其中"冷却到一定温度"能获得纯度较高的硝酸钾晶体的原因是 。
(4)发展。现代国防、开矿等使用的烈性炸药,主要成分为硝化甘油(C 3H 5O 9N 3)。
①硝化甘油在人体内能缓慢氧化生成一种氮的氧化物,用于治疗心绞痛。该氧化物中氮为+2价,其化学式为 。
合成硝化甘油的化学方程式为C 3H 8O 3+3HNO 3═C 3H 5O 9N 3+3H 2O.现用46kg甘油(C 3H 8O 3)和足量硝酸反应,理论上能生成多少硝化甘油?(写出计算过程)
高纯碳酸钙广泛应用于精密电子陶瓷、医药等的生产。某兴趣小组按如图所示实验步骤,模拟工业流程制备高纯碳酸钙。请回答下列问题。
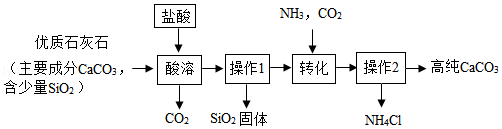
(1)“酸溶”过程中,将一定浓度的盐酸缓慢加入粉碎后的优质石灰石中,同时搅拌。搅拌的目的是 。
(2)“操作1”、“操作2”步骤中,需要用到的玻璃仪器有烧杯、玻璃棒和 。
(3)“操作2”中分离得到的NH4Cl,在农业上可用作 。
以镁矿石(主要成分MgCO3、SiO2)为原料生产MgO的主要工艺流程如图:
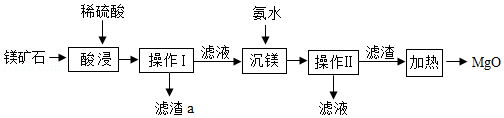
已知:SiO2难溶于水和常见的酸;“沉镁”过程中有Mg(OH)2生成。
(1)操作Ⅰ、Ⅱ的名称是 。
(2)滤渣a的主要成分是 (填化学式)。
(3)“酸浸”时稀硫酸与镁矿石主要成分发生反应的化学方程式是 。
(4)“加热”过程中发生 反应(填基本反应类型)。
粗盐中含有泥沙等不溶性杂质,还含有氯化钙、氯化镁、硫酸钠等可溶性杂质。
提纯粗盐并制取纯碱的工艺流程如图:
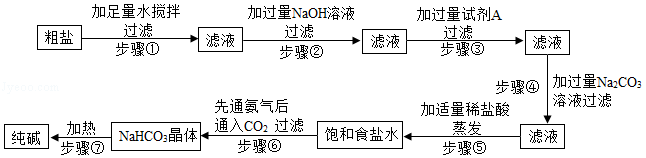
已知:①20℃时,将CO2通入含有NH3的饱和NaCl溶液中生成NaHCO3晶体和NH4Cl溶液
②20℃时,几种物质在水中的溶解度/g
NaCl |
NH4Cl |
NaHCO3 |
36.0 |
37.2 |
9.6 |
请根据上述题中有关信息,回答下列问题:
(1)步骤③中加入试剂A的化学式是 ;
(2)步骤④中加入过量Na2CO3溶液的目的是 ;
(3)在步骤⑥反应中,有NaHCO3晶体析出,而没有NH4Cl和NaCl析出的原因是 ;
(4)步骤⑦中NaHCO3转化为纯碱的化学反应方程式是2NaHCO3 Na2CO3+CO2↑+H2O,该化学反应属于 反应(填基本反应类型)。
某种手机电路板主要含有Fe、Cu、Ag(银)、Ni(镍)等金属及非金属基材,如图是某工厂回收金属铜的工艺流程图。已知:2Cu+O2+2H2SO4 2CuSO4+2H2O。
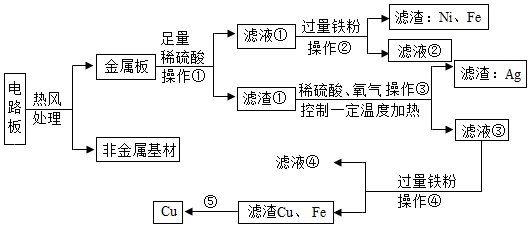
(1)电路板不直接焚烧而采取热风处理的主要目的是 。
(2)操作①的名称是 。
(3)写出滤液③与铁粉反应的化学方程式 。
(4)Fe、Cu、Ag、Ni在溶液中的金属活动性顺序由强到弱依次为 。
(5)写出⑤得到纯铜的一种方法 。
某硫酸厂以黄铁矿(主要成分是FeS2)为主要原料,生产硫酸的简要流程图如图:

(1)写出流程图中硫的一种氧化物名称: 。
(2)催化反应室中发生的是化合反应,写出该反应的化学方程式 。
(3)实验室里稀释浓硫酸的方法是:把 ,并不断搅拌。
(4)沸腾炉中的炉渣(Fe2O3)可用于炼铁,写出用一氧化碳和炉渣炼铁的化学方程式: 。
(5)排放的废气中含有SO2,为实现“变废为宝”,该硫酸厂脱硫工艺的主要反应是2SO2+2CaO+O2 2CaSO4,该反应前后化合价升高的元素是 。
接触法生产硫酸的工艺流程如图:
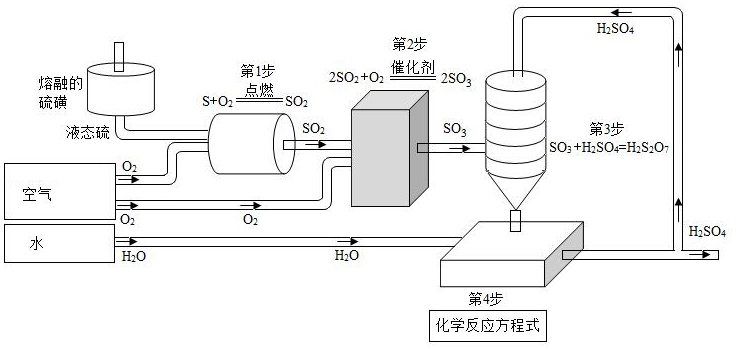
回答下列问题:
(1)第1步反应中将液态硫喷入反应器的目的是 ;
(2)写出第4步化学反应方程式 ;
(3)第1步至第4步流程中涉及到的物质,属于氧化物的有 (用化学式表示);
(4)若用3.2吨硫为原料,则理论上能产出98%的浓硫酸 吨。
现对一批已生锈的弹壳进行回收利用,主要流程如图:

[资料]①该弹壳由铜锌合金制成,其锈的主要成分是Cu2(OH)2CO3。
②Cu2(OH)2CO3能与稀硫酸反应生成硫酸铜,其他杂质不溶于水,也不参与反应。
(1)为加快步骤一的反应速率,可采用的方法是 (填一种即可);
(2)溶液A中的溶质是 ;
(3)步骤三中发生反应的化学方程式为 ;
(4)回收锌的质量 废弃弹壳中锌元素的质量(选填“大于”、“小于”或“等于”);
(5)改变铜锌合金中锌的含量可以得到不同机械性能的黄铜。现欲制备120吨(t)含锌量小于35%的黄铜,该类黄铜具有良好的塑性,能承受冷热加工,但在200℃~700℃之间热加工时易断裂。下列符合原料配比及热加工条件的是 (填字母序号)。
A.锌44t 铜76t 750℃
B.锌38t 铜82t 500℃
C.锌55t 铜65t 190℃
D.锌25t 铜95t 750℃
高氯酸钾(KClO4)是一种性能稳定的物质,主要用作发烟剂、引火剂、氧化剂和化学分析试剂,工业生产上生产的高氯酸钾的工艺流程如图:

回答下列问题:
(1)为加快氯酸钾的溶解,可采取的措施为 。
(2)流程中的分离操作相当于实验室中的 。
(3)反应釜中发生的化学反应方程式为 ,该反应属于基本反应类型中的 反应。
(4)电解NaClO3溶液时,除产生NaClO4外,还得到一种清洁的高能燃料,该反应的化学方程式为 。
某兴趣小组查阅资料得知:氯酸钾(KClO3) 在加热和二氧化锰做催化剂的条件下生成氯化钾和氧气。他们利用该原理制取氧气,并回收提纯氯化钾和二氧化锰,按以下流程图进行实验,按要求完成下列问题:

(1)步骤Ⅰ中发生反应的化学方程式为 。
(2)步骤Ⅳ中操作Y的名称是 。
(3)步骤Ⅲ中“洗涤”操作2次后,收集第3次的洗涤液并进行检验。取少量洗涤液于试管中,滴加 溶液,有白色沉淀生成,说明还没有洗涤干净。
(4)实验结束后,理论上能够回收得到 克二氧化锰。
“84消毒液”在抗击新冠病毒时可作环境消毒剂,其有效成分为次氯酸钠(NaClO)。如图为一种制取“84消毒液”的简化流程:
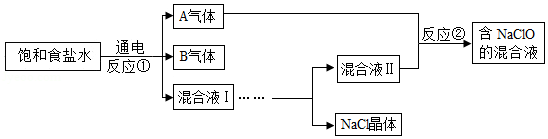
图中A、B气体均为单质,混合液、Ⅰ、Ⅱ的溶质均为NaOH和NaCl。
回答下列问题:
(1)B气体是一种新型能源,也可作燃料。与其它燃料相比,其优点有 (写一点即可)。
(2)反应①的化学方程式为 。
(3)混合液Ⅰ经蒸发浓缩、冷却结晶、 后得到混合液Ⅱ和NaCl晶体。
(4)混合液Ⅱ中的NaOH与A气体发生反应②,产生NaClO、NaCl和H2O,该反应的化学方程式为 。
(5)“84消毒液”与洁厕灵混用时会产生有毒的Cl2,其化学方程式为:NaClO+2HCl═NaCl+Cl2↑+H2O
对该反应的分析错误的是 (填选项序号)。
a.NaClO、H2O均为氧化物
b.不属于任何基本反应类型
c.只有氯元素的化合价发生了改变
广西蕴含丰富的铝土资源,铝工业是广西传统优势产业,某工厂用铝土矿(主要成分为Al2O3、Fe2O3、SiO2等)提取Al2O3,提取流程如图所示:

已知Ⅰ.NaOH+Al(OH)3═NaAlO2+2H2O
Ⅱ.NaAlO2+CO2+2H2O═Al(OH)3↓+NaHCO3
(1)“酸浸”时,通常将铝土矿进行粉碎处理,“粉碎”的主要目的是 。
(2)经检验,滤渣Ⅰ的主要成分是SiO2,由此推测SiO2的性质有 (填序号)。
A.难溶于水
B.化学性质很活泼
C.不能与盐酸反应
D.不能与NaOH溶液反应
(3)溶液Ⅱ中含有的溶质是 (用化学式表示)。
(4)滤渣Ⅲ加热时,生成Al2O3和一种常见的氧化物,请写出反应的化学方程式 ,该反应属于 反应(填基本反应类型)。
试题篮
()