海水中含有丰富的镁,目前世界上生成的镁60%来自于海水。分离出食盐的海水称作苦卤水,其中含有丰富的MgCl2.工业上以苦卤水为原料制取金属镁的流程如图:

(1)写出沉淀槽中发生反应的化学方程式 , 。
(2)Y与Z反应后的产物溶于水可得X溶液,从而实现了Y的循环利用,则Z的化学式为 ,X溶液的名称是 。
(3)烘干后得到的MgCl2中可能含有的杂质是 。
高锰酸钾是常用的氧化剂。如图是实验室模拟工业上制备高锰酸钾晶体的操作流程:

(1)完成操作③所需要的玻璃仪器是 (填一种即可);实验中通过操作②所析出高锰酸钾晶体,说明高锰酸钾的溶解度随温度升高而 ;
(2)操作流程中可循环利用的物质是 ;
(3)氢氧化钾、二氧化锰和氧气在高温条件下煅烧,生成锰酸钾和水,该反应的化学方程式为 。
高锰酸钾是常用的氧化剂。如图是实验室模拟工业上制备高锰酸钾晶体的操作流程:

(1)完成操作③所需要的玻璃仪器是 (填一种即可);实验中通过操作②所析出高锰酸钾晶体,说明高锰酸钾的溶解度随温度升高而 ;
(2)操作流程中可循环利用的物质是 ;
(3)氢氧化钾、二氧化锰和氧气在高温条件下煅烧,生成锰酸钾和水,该反应的化学方程式为 。
废旧金属可回收利用,某化学兴趣小组用合金废料(含Fe、Cu和Al)制取FeSO 4溶液和回收金属铜,实验流程如图所示(部分生成物已略去)。已知:2Al+2NaOH+2H 2O═2NaAlO 2+3H 2↑

(1)单质铁的金属活动性比铜 (填"强"或"弱");
(2)操作Ⅰ的名称 ,操作Ⅱ用到的玻璃仪器有烧杯、玻璃棒和 (填仪器名称);
(3)若取FeSO 4溶液适量,滴入BaCl 2溶液,发生反应的化学方程式为 ,该反应属于基本反应类型中的 反应;
(4)步骤B的化学方程式为 ;
(5)铝制品在空气中耐腐蚀的原因是 。
氯化亚铜(CuCl)广泛应用于冶金、电镀、医药等行业。已知CuCl难溶于水和乙醇,在潮湿空气中易变质。CuCl的制备流程如下:
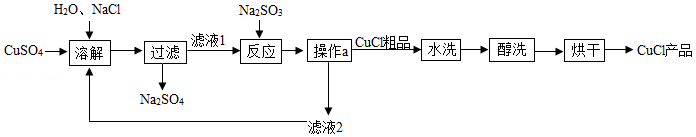
(1)“滤液1”中除了Na+、SO42﹣外,还存在较多的离子是 、 (写离子符号)
(2)“反应”中发生的化学变化是2CuCl2+Na2SO3=2CuCl↓+2NaCl+SO3,产生的SO3迅速与水化合生成一种酸,该反应的化学方程式为 。
(3)“操作a”的名称是 。本流程中可以循环利用的物质(水除外)是 。(写化学式)
(4)可用“水洗”的原因是 ,“醇洗”的目的是 。
(5)160g CuSO4与足量NaCl经上述制备流程,可生成的CuCl最多是 g。
深圳是海滨城市,海水资源丰富。镁被称为“国防金属”广泛地应用于火箭、飞机、轮船等制造业。工业上可从海水中提取镁,其物质的转化关系如图所示。(其中部分生成物已省略)
根据以上转化关系,回答下列问题:
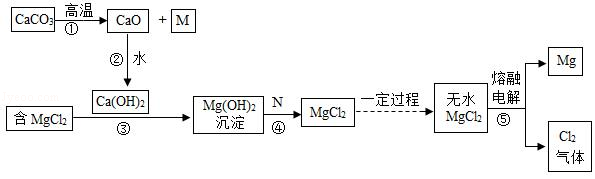
(1)M是一种常用于灭火的气体,M的化学式是 ,若在M的饱和溶液中滴入几滴紫色石蕊溶液,则溶液变 色;
(2)反应②过程中会 (填“吸收”或“放出”)热量;
(3)反应③属于 反应(填基本反应类型);
(4)N是 (只有一个正确选项,选填字母);
A.硫酸 B.盐酸 C.氢氧化钠溶液 D.氯化钠溶液
(5)写出反应④的化学方程式: ;
(6)写出反应⑤的化学方程式: 。
保险粉(化学式为Na2S2O4)在工农业生产中有广泛的用途,Na2S2O4在碱性溶液中稳定,在中性和酸性溶液中极不稳定,在NaCl存在下,Na2S2O4在水中溶解度显著下降.制备流程如图:

(1)反应Ⅰ的原理为:Zn+2SO2═ZnS2O4,该反应类型为 .
(2)反应Ⅱ为复分解反应,该反应的化学方程式为 .
(3)操作a的名称为 .
(4)滤液中含有Na2S2O4,为使Na2S2O4结晶析出还需要加入少量NaOH的原因是 ,加入NaCl的原因是 .
(5)198gZn(OH)2理论上能得到Zn的质量为 g.
以某矿山酸性废水(主要含硫酸、硫酸铁、硫酸铜和硫酸锌等)为原料,通过下述流程可将废水中的铁、铜和锌分步沉淀,实现回收利用。

(1)步骤①中,加入Ca(OH)2有两个作用。
一是中和废水中的硫酸,该反应的化学方程式为 ;
二是将硫酸铁转化为Fe(OH)3,该反应属于 (填基本反应类型)。
(2)步骤③中,锌泥中最主要的含锌化合物的化学式为 ;
(3)为分步回收铁、铜、锌等金属资源且直接得到铜单质,只需改变上述流程中的某步骤加入的试剂即可。该步骤和应加入的试剂分别是 。
纳米碳酸钡是一种重要的无机化工产品,其生产原料的主要成分是BaCO 3同时还有少量SiO 2.生产工艺流程简要如图:

已知 SiO 2是一种难溶于水也难溶于酸的固体。请回答下列问题:
(1)SiO 2中Si的化合价是 。
(2)若在实验室中进行该实验操作|的名称是 。
(3)写出工艺中BaCO 3转化成BaCl 2的化学方程式 。
(4)上述工艺中可循环利用的物质是 ,该工艺中副产物A可用作 (写种用途即可)。
请沿用科学家认识事物的方法认识"空气"。
(1)从分类角度:空气属于 (填"混合物"或"纯净物")
(2)从微观角度:用"  "表示氮原子,"
"表示氮原子,"  "表示氧原子。
"表示氧原子。
①用"  "可表示的微粒是 (填名称)。
"可表示的微粒是 (填名称)。
②同温同压下,气体的体积比等于分子数目比。若空气中其它成分忽略不计。图中可表示空气微观模型的是 (填标号)。

(3)从变化角度:
已知:常温下,氮气沸点﹣196℃,氧气沸点﹣183℃.将燃着的木条置于盛满液态空气的烧杯口,观察到的现象是 。该烧杯放置一段时间后,液态物质剩余约 体积,其主要成分是 。
(4)从应用角度:利用空气制取氮肥的流程如图所示。
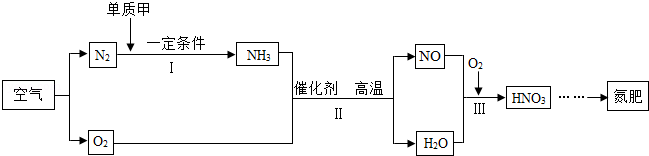
①Ⅰ中参加反应的单质甲为 。
②Ⅱ中反应的化学方程式为 。
③物质所含元素化合价发生变化的反应称为氧化还原反应。反应Ⅲ (填"属于"或"不属于")氧化还原反应。
(5)从环保角度:下列保护空气措施合理的有 (填标号)。
A.工厂通过加高烟囱直接排放废气
B.推广使用乙醇汽油代替普通汽油
C.提倡步行、骑自行车等"低碳"出行方式。
利用电石渣[主要成分为Ca(OH)2、MgO]制备硫酸钙的主要工艺流程如图: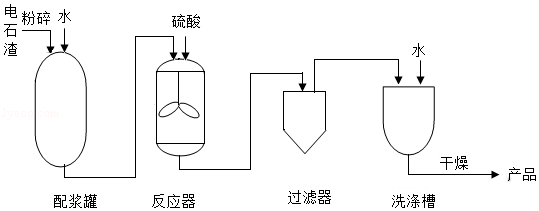
已知:MgO难溶于水;MgSO4易溶于水; CaSO4微溶于水。
(1)反应器中搅拌的目的是 。
(2)反应器中发生的反应主要有MgO+H2SO4═MgSO4+H2O和 。
(3)上述流程中,用于分离提纯的设备有 。
超细碳酸钙可用于生产钙片、牙膏等产品。利用碳化法生产超细碳酸钙的主要流程示意如下:
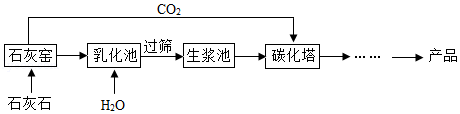
(1)石灰石主要成分的化学式为 。
(2)乳化池中,生石灰与水发生反应,其化学方程式为 。
(3)过筛的目的是拦截 (填“大于”或“小于”)筛孔直径的颗粒。
(4)碳化塔中反应的化学方程式为 。
实验室以MnO 2为原料制备少量高纯MnCO 3的流程如下:
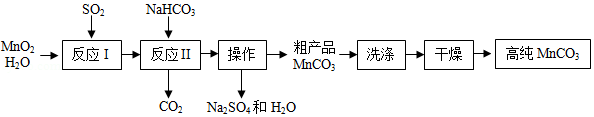
已知:①反应Ⅰ的化学方程式:MnO 2+SO 2═MnSO 4;
②MnCO 3、Mn(OH) 2均难溶于水,MnCO 3在100℃时开始分解。
(1)反应Ⅰ属于基本反应类型中的 反应。
(2)流程中"操作"的名称为 ,所需要的主要玻璃仪器有 。
(3)反应Ⅱ的化学方程式为 。反应Ⅱ需控制溶液的酸碱性,若碱性过强,MnCO 3粗产品中将混有 (填化学式)。
(4)验证MnCO 3粗产品表面附着有Na 2SO 4杂质:取样品少许,向其中加入水,搅拌、过滤,向滤液中加入适量的 (填化学式)溶液,有白色沉淀产生。
(5)为获得高纯MnCO 3,需选择"低温"干燥的原因是 。
实验室利用反应所得CuSO4稀H2SO4混合液制备CuSO4“5H2O,其主要流程如图:

(1)试剂X应选用 (选填序号).
a.Cu b.CuO c.Fe
(2)操作A中,所用玻璃仪器有 、玻璃棒、烧杯.
(3)操作B为蒸发浓缩、 、过滤.
(4)操作C为洗涤、低温干燥,其中洗涤剂不可选用 (选填序号).
a.热水 b.冰水 c.饱和CuSO4溶液.
试题篮
()