某兴趣小组查阅资料得知:氯酸钾(KClO3) 在加热和二氧化锰做催化剂的条件下生成氯化钾和氧气。他们利用该原理制取氧气,并回收提纯氯化钾和二氧化锰,按以下流程图进行实验,按要求完成下列问题:

(1)步骤Ⅰ中发生反应的化学方程式为 。
(2)步骤Ⅳ中操作Y的名称是 。
(3)步骤Ⅲ中“洗涤”操作2次后,收集第3次的洗涤液并进行检验。取少量洗涤液于试管中,滴加 溶液,有白色沉淀生成,说明还没有洗涤干净。
(4)实验结束后,理论上能够回收得到 克二氧化锰。
“84消毒液”在抗击新冠病毒时可作环境消毒剂,其有效成分为次氯酸钠(NaClO)。如图为一种制取“84消毒液”的简化流程:
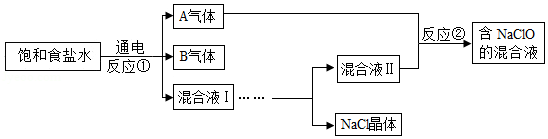
图中A、B气体均为单质,混合液、Ⅰ、Ⅱ的溶质均为NaOH和NaCl。
回答下列问题:
(1)B气体是一种新型能源,也可作燃料。与其它燃料相比,其优点有 (写一点即可)。
(2)反应①的化学方程式为 。
(3)混合液Ⅰ经蒸发浓缩、冷却结晶、 后得到混合液Ⅱ和NaCl晶体。
(4)混合液Ⅱ中的NaOH与A气体发生反应②,产生NaClO、NaCl和H2O,该反应的化学方程式为 。
(5)“84消毒液”与洁厕灵混用时会产生有毒的Cl2,其化学方程式为:NaClO+2HCl═NaCl+Cl2↑+H2O
对该反应的分析错误的是 (填选项序号)。
a.NaClO、H2O均为氧化物
b.不属于任何基本反应类型
c.只有氯元素的化合价发生了改变
广西蕴含丰富的铝土资源,铝工业是广西传统优势产业,某工厂用铝土矿(主要成分为Al2O3、Fe2O3、SiO2等)提取Al2O3,提取流程如图所示:

已知Ⅰ.NaOH+Al(OH)3═NaAlO2+2H2O
Ⅱ.NaAlO2+CO2+2H2O═Al(OH)3↓+NaHCO3
(1)“酸浸”时,通常将铝土矿进行粉碎处理,“粉碎”的主要目的是 。
(2)经检验,滤渣Ⅰ的主要成分是SiO2,由此推测SiO2的性质有 (填序号)。
A.难溶于水
B.化学性质很活泼
C.不能与盐酸反应
D.不能与NaOH溶液反应
(3)溶液Ⅱ中含有的溶质是 (用化学式表示)。
(4)滤渣Ⅲ加热时,生成Al2O3和一种常见的氧化物,请写出反应的化学方程式 ,该反应属于 反应(填基本反应类型)。
碳酸钾广泛应用于玻璃、纺织印染和肥皂生产等领域。制取碳酸钾的工艺流程示意图如图: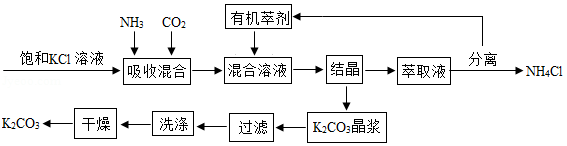
温度/℃ |
0 |
10 |
20 |
30 |
40 |
60 |
80 |
100 |
K2CO3的溶解度/g |
107.0 |
109.0 |
111.0 |
114.0 |
117.0 |
126.0 |
139.0 |
156.0 |
根据如图表信息,回答下列问题:
(1)生成碳酸钾的化学方程式为 。
(2)上述流程中可循环使用的物质是 ,NH4Cl在农业上可用作 。
(3)得到K2CO3晶浆的结晶方法是 。
(4)上述流程中洗涤K2CO3晶体应选用 (填序号)。
①NH4Cl溶液
②热水
③饱和K2CO3溶液
某工厂生产硼砂产生的固体废料,主要含有MgCO3、CaCO3、SiO2、Al2O3和Fe2O3等,其中MgCO3质量分数为63%.回收镁的工艺流程如图
(1)“酸浸”时MgCO3发生反应的化学方程式为 。
(2)“调pH”前滤液Ⅰ的pH 7(填“>”或“<”)。
(3)滤液Ⅲ中可回收的主要物质 (填化学式)。
(4)已知固体废料质量为m,理论上可生产Mg(OH)2的质量为 。
(5)某BaCO3中混有SiO2杂质,简述提纯该BaCO3的实验操作: 。
中国科学院张青莲院士对铟、铱、锗等的相对原子质量测定作出了杰出贡献。锗是重要的半导体材料,由锗精矿(含GeO2、GeS2、As2O3等)制备金属锗的步骤如下:
①焙烧,GeS2转化为GeO2,然后用盐酸溶解得到GeCl4.②用Cl2将杂质转化为不易挥发的H3AsO4.③加热混合溶液使GeCl4气化,再冷凝为液态,经过一系列转化得到GeO2.④用H2将GeO2还原为Ge,同时H2转化为H2O。
(1)步骤①盐酸溶解GeO2的化学方程式为 。
(2)完成步骤②除杂反应的化学方程式:AsCl3+4H2O+Cl2═H3AsO4+5 。
(3)步骤③分离GeCl4的方法是 (填标号)。
A.过滤
B.蒸馏
C.升华
D.蒸发
(4)步骤④消耗H2和生成Ge的质量之比为 。
氯化钙(CaCl2)可用作干燥剂、混凝土防冻剂等。实验室用工业大理石(含有少量Al2O3、Fe2O3、SiO2等杂质)制备氯化钙的主要流程如下:
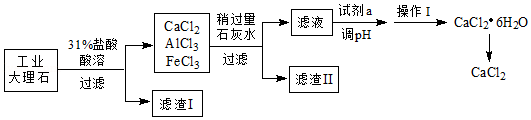
请回答下列问题:
(1)配制31%的稀盐酸730g,需要36.5%的浓盐酸 g。
(2)酸溶时碳酸钙参与反应的化学方程式为 。
(3)滤渣I的成分为 ,滤渣II中含有Al(OH)3和 。
(4)过滤使用到的玻璃仪器有 。操作I采用的方法是:蒸发浓缩、 、 、过滤。
(5)加入试剂a的目的是中和稍过量的石灰水,该反应的化学方程式为 。
某矿石主要成分是MgO,含少量的Fe2O3、CuO和SiO2杂质。用该矿石制备Mg(OH)2的工艺流程简图如图:
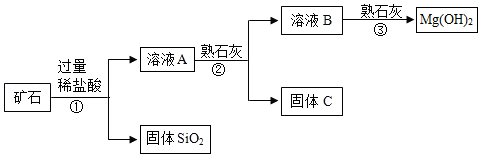
回答下列问题:
(1)步骤①和步骤②均用到的操作是 。
(2)溶液A中所含的阳离子有Fe3+、Cu2+、Mg2+和 (填离子符号)。
(3)已知部分金属阳离子以氢氧化物形成沉淀时溶液的pH见下表:
对应离子 |
Fe3+ |
Cu2+ |
Mg2+ |
开始沉淀时的pH |
1.9 |
4.2 |
9.1 |
完全沉淀时的pH |
3.2 |
6.7 |
11.1 |
步骤②加入熟石灰,调节溶液的pH范围为 ,固体C中所含成分的化学式为 。
(4)步骤③制得Mg(OH)2的化学方程式为 。
稀土元素被誉为“工业的维生素”,是不可再生资源,应用广泛。
①稀土元素与铝、钛等金属熔合,形成特种合金,其性能会有较大提高,强度更好,抗腐蚀性能更强。坦克、飞机、核潜艇等的制造都用到了特种合金。
②稀土元素在自然界中以化合物的形式存在。二氧化铈(CeO2)是稀土氧化物中用途极广的一种材料,因为具有较为独特的萤石晶体结构,使得其具有特殊的性能。主要用于玻璃、原子能、电子管等工业。
③中国的稀土储量最多时占世界的71.1%,目前占比在23%以下。中国并非世界上唯一拥有稀土的国家,却在过去几十年承担了世界稀土供应的角色,结果付出了破坏自身天然环境与消耗自身资源的代价。近几年,我国出台了一系列政策,采取了出口控制等措施,保护我国现有的稀土资源。
阅读以上材料,回答以下问题:
(Ⅰ)稀土元素铼与“太空金属”钛制成的钛铼合金,可用来制造核潜艇。请写出钛铼合金的优良性能(任写一点) 。
(Ⅱ)关于稀土资源,下列说法正确的是 (填序号)
A.稀土的开采与环境问题无关
B.稀土在材料工业方面发挥着重要作用,它是万能的
C.稀土元素化学性质稳定,在自然界中以单质形式存在
D.稀土不可再生,珍贵,保护稀土资源,是我们义不容辞的责任
(Ⅲ)某品牌平板电视显示屏生产过程中产生大量的废玻璃粉末(含SiO2、Fe2O3、CeO2等物质)。以此粉末为原料进行资源回收,其工艺流程如图:
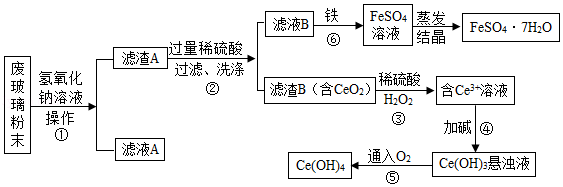
已知:2NaOH+SiO2=Na2SiO3+H2O,Na2SiO3溶于水。
(1)第①步操作的名称是 ;
(2)第②步加入过量稀硫酸的目的是 ;
(3)洗涤滤渣B的目的是为了除去 (填离子符号),提高产品的纯度;
(4)若第④步加的碱为NaOH,写出该反应的化学方程式 。
用废铜屑生产硫酸铜晶体(CuSO4•5H2O)的流程如下: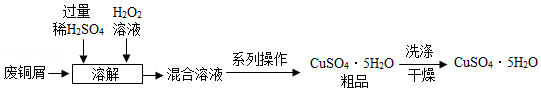
(1)“溶解”时需要加热,但温度不宜过高,原因是 。
(2)“系列操作”包括:除杂、蒸发浓缩、 、过滤等。过滤时用到的玻璃仪器有烧杯,漏斗、 。
(3)“洗涤”时为减少晶体损失,最好选用 (选填序号)。
a.热水 b.冰水 c.95%的酒精溶液
实验室以某石灰石(含少量Fe2O3)为原料制备高纯CaCO3的步骤如下。
溶解 向石灰石样品中加入适量盐酸,至反应完全。
除铁 加入氨水调节pH,然后加入适量Ca(OH)2,充分反应后过滤。
沉淀 向滤液中补充氨水,通入CO2,反应一段时间。
分离 过滤、洗涤、干燥得高纯CaCO3。
(1)溶解时,CaCO3、Fe2O3分别与盐酸反应的化学方程式为 、 。判断样品已完全反应的实验现象是 。
(2)除铁时,选用Ca(OH)2而不选用NaOH,其主要原因是Ca(OH)2价格低且来源广、 、 ;过滤所得滤渣的主要成分为 。
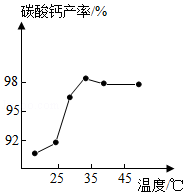
(3)沉淀时,其他条件相同,反应温度对CaCO3产率的影响如图。高于35℃时,CaCO3产率下降的主要原因是 、 (4)分离时,若向过滤所得滤液中加入 (填化学式)并加热,则可回收NH3。
(5)该实验中可以循环利用的物质有H2O和 。
(6)石灰厂煅烧石灰石生产CaO,若要得到28t CaO,则至少需要含CaCO3 90%的石灰石多少吨?(写出计算过程,保留一位小数。)
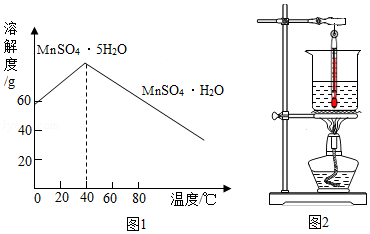
以MnO2为原料制备MnSO4•H2O的工业流程如图。
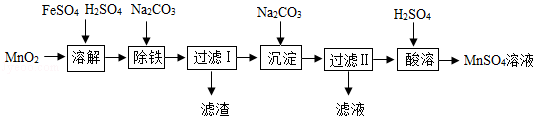
已知:①沉淀时的化学方程式为7MnSO4+7Na2CO3+11H2O=MnCO3•6Mn(OH)2•5H2O↓+7Na2SO4+6CO2↑
②MnSO4•H2O和MnSO4•5H2O易溶于水,难溶于乙醇。
③MnSO4的溶解度曲线如图1所示。
(1)溶解时,为控制80℃,在实验室可用水浴加热如图2.水浴加热需要的玻璃仪器有酒精灯、 、 。水浴加热的优点有 。能加快溶解的方法有 (写一种)。
(2)除铁时需要搅拌,搅拌的作用是 。
(3)过滤I所得滤液的溶质主要是Na2SO4和 。过滤时,玻璃棒的作用是 。
(4)酸溶时,MnCO3•6Mn(OH)2•5H2O与足量稀硫酸反应的化学方程式为 。
(5)请补充完整由流程中“酸溶”所得MnSO4溶液制备MnSO4•H2O的实验方案:将MnSO4溶液转移至蒸发皿中, ,在高于40℃时趁热过滤, ,100℃烘干得MnSO4•H2O。
由氯化钡废液(杂质为FeCl3及微量NaCl)制备产品BaC12•2H2O的流程如图。
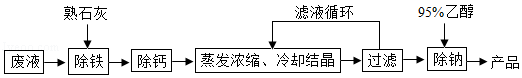
(1)氯化钡废液属于 (填“纯净物”或“混合物”)。FeCl3中铁元素的化合价是 。
(2)煅烧石灰石制取生石灰的化学方程式为 ,生石灰变成熟石灰的过程是 过程(填“吸热”或“放热”),石灰水能使紫色石蕊试液变 色。石灰石和熟石灰中常用于改良酸性土壤的是 。
(3)用95%乙醇(C2H6O)洗涤滤渣可除微量NaCl.C2H6O由 种元素组成,是 化合物(填“有机”或“无机”)。C2H6O在O2中完全燃烧生成CO2和 。2个CO2分子可用化学符号表示为 。煤、氢气、乙醇三种燃料中,最清洁的是 。
(4)结合流程和表回答:工业上选择25℃而不选择5℃进行冷却结晶的主要原因是①滤液多次循环后,25℃与5℃结晶产品的总产率基本相同;② 。
表:每次结晶时,温度对产品纯度和产率的影响
冷却结晶的温度/℃ |
产品的纯度/% |
产品的产率/% |
5 |
99 |
72 |
25 |
99 |
60 |
实验室以一种工业废渣(主要成分为MgCO3、MgO和SiO2)为原料制备MgCO3•3H2O.其主要实验过程如图:

已知:SiO2不溶于水,常温下不与硫酸、碳酸钠反应。
(1)“酸溶”时发生反应的化学方程式为 和 。
(2)“过滤Ⅱ”所得滤液中含有的主要离子有 (填离子符号)。
(3)“反应”步骤前后均有过滤,能否省去“过滤Ⅰ”只进行“过滤Ⅱ”。 (填“能”或“否”),理由是 。
(4)“酸溶”时所加硫酸溶液不宜过量太多的原因是 。
试题篮
()