化学兴趣小组为测定某石灰石样品中碳酸钙的质量分数,取26g石灰石样品放在烧杯中,然后向其中逐渐加入稀盐酸,使之与样品充分反应,恰好完全反应(杂质不参加反应)时,加入稀盐酸的质量为90g,反应后烧杯中物质的总质量为105g。请计算:
(1)反应生成二氧化碳的质量;
(2)样品中碳酸钙的质量分数(结果保留到0.1%)。
为测定某
溶液的溶质质量分数,用溶质质量分数为7.3%的稀盐酸进行滴定。现取待测液50.0 g,滴定过程如图所示。
(滴定反应为:
,
的相对原子质量为108,计算结果均保留1位小数)

(1)
的相对分子质量为:;
(2)计算
溶液的溶质质量分数:;
(3)计算恰好完全反应时,所得溶液的溶质质量分数:。
将Na2CO3和NaCl固体混合物22.3 g放入烧杯中,加入182.1 g稀盐酸恰好完全反应。待没有气泡逸出后,称量烧杯中剩余物质总质量为200 g。请计算:
(1)生成二氧化碳的质量是_ __;
(2)所得溶液中溶质的质量分数是多少?
烧杯中装有一定量硫酸和硫酸铜的混合溶液,已知该溶液中含H2SO4的质量为9.8g。某同学为测定该混合溶液中硫酸铜的质量,向烧杯中逐渐加入10%的NaOH溶液,得到沉淀的质量记录如下:
(1)得到沉淀的总质量为 g,该混合溶液中硫酸铜的质量为 g。
(2)参加反应的NaOH溶液的总质量是多少克?(要求写出计算过程)
(3)画出在该混合溶液中加入NaOH溶液质量与生成沉淀质量变化关系的曲线。
某化学兴趣小组的同学采集了一些大理石样品,为测定该样品中碳酸钙的质量分数,取样品6g粉碎成粉末状置于烧杯中,向其中加入10%的稀盐酸并不断搅拌,恰好不再有气泡产生时(已知杂质不与稀盐酸反应),共用去稀盐酸36.5g。
(1)计算样品中碳酸钙的质量分数。
(2)计算反应后所得溶液中溶质的质量分数?(结果保留到0.1%)
实验室常用石灰石和稀盐酸制取二氧化碳,现取含碳酸钙80%的石灰石12.5
和94.4
稀盐酸恰好完全反应(石灰石中的杂质不溶于水,也不与稀盐酸反应)。求:
(1)生成二氧化碳的质量;
(2)恰好完全反应后所得溶液中溶质的质量分数。
如图是某胃药标签的部分内容。小明同学测定该药品中
含量的过程如下:取10粒该药剂研碎后放入烧杯中,加入50克水后充分搅拌,再向其中滴加稀盐酸至溶液的pH=7时(已知药品中的其它成分既不溶于水,也不与稀盐酸反应),形成
的不饱和溶液,共消耗稀盐酸11.5克。称得反应后烧杯内物质的总质量为64.3克。

请计算:(1)反应完成后生成气体的质量为g。
(2)反应后烧杯中溶液的质量和胃药中
的质量分数。
某研究学习小组欲测定石灰石中碳酸钙的质量分数,采用的方法如下:取该石灰石样品
,把
稀盐酸分四次加入,实验过程所得数据如下表(已知石灰石样品中含有的二氧化硅等杂质不溶于水,不与稀盐酸反应)。根据实验数据计算:

(1)表中
的数值为。
(2)样品中碳酸钙的质量分数是。
(3)求盐酸中溶质的质量分数。
某腐蚀印刷电路板的废液中含有
和
,为了分析该废液的组成,取1 000 g废液,设计如下实验方案进行探究:
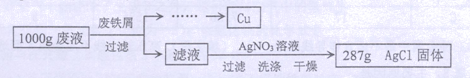
实验过程中加入废铁屑的质量、析出
的质量的数据记录如下表:
| 废铁屑的质量/g |
20 |
40 |
60 |
80 |
| 析出
的质量/g |
12.8 |
25.6 |
32 |
32 |
(注:废铁屑中的杂质不溶于废液也不与废液反应,不考虑过滤中的损失。)
(1)1000 g废液与足量废铁屑完全反应,析出
的质量为。
(2)废铁屑中单质Fe的质量分数为。
(3)计算1000 g废液中
的质量分数。(写出计算过程,结果保留小数点后一位)
(4)1000 g废液中
的质量分数为。(结果保留小数点后一位)
胃酸主要成分是盐酸,正常人胃液每日需要盐酸溶质质量约为
.某患者每日分泌盐酸溶质质量为9.0
,为治疗胃酸过多需服用图9所示抑酸剂,发生反应:
.请计算并回答:按说明书用法用量,每天最多可中和胃液中盐酸溶质质量是多少克?理论上能否使该患者胃液中盐酸溶质质量恢复到正常范围?(写出计算过程,结果精确到0.001)

某纯碱样品中含有少量
,小丽同学取该样品23
全部溶解于150
水中,再逐滴加入160
稀盐酸,反应中产生的气体的质量与盐酸的用量关系如图所示。(提示:相关反应为
)计算当恰好完全反应时:
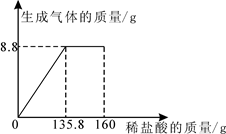
(1)产生的二氧化碳的质量是克。
(2)此时所得到的溶液中溶质的质量分数(写出必要的计算过程,结果保留到0.1
)。
一定质量的氯化钡溶液和10g溶质质量分数为9.8%的稀硫酸恰好完全反应后,过滤得到28.47g滤液。请计算:
(1)生成硫酸钡沉淀的质量;
(2)氯化钡溶液的溶质质量分数。
将13.7g Na2CO3和NaHCO3的固体混合物,加热至固体质量不再减少,然后向此固体中加入一定量的氯化钙溶液,恰好完全反应后过滤,得到117g溶质质量分数为10%的不饱和溶液,则原固体混合物中钠元素的质量为
| A.2.3g | B.4.6g | C.6.9g | D.9.2g |
华雪同学想测定某
合金中两种金属的质量比。称取这种合金
,加入足量
溶液充分反应后过滤,将所得固体洗涤、干燥后称量,质量为
。
(1)发生反应的化学方程式为。
(2)试计算该合金中铜与银的质量比。(请写出计算过程)
(3)华雪同学认为还可算出该AgNO3溶液中溶质的质量分数,于是进行了多次实验,记录了每次使用
溶液的质量
(
溶液)和充分反应后所得固体的质量
,并绘制了下图,则
溶液中溶质的质量分数是多少?(请写出计算过程,用含
的代数式表示)

某硫酸厂废水中含有少量硫酸,为达标排放,技术员小张对废水中硫酸的含量进行检测。
(1)配制溶液:欲配制溶质质量分数为4%的NaOH溶液100g,需要NaOH固体 g,水 ml(水的密度为1g/cm3);
(2)检测分析:取废水样品100g,向其中逐滴加入NaOH溶液至恰好完全反应时,消耗4%的NaOH溶液20g(假设废水中其它成分均不和NaOH反应)。 试计算废水中硫酸的质量分数?
试题篮
()