某校化学兴趣小组同学用一瓶含有少量氯化钠的硫酸钠固体样品,进行如下图所示的实验。
已知:Na2SO4 + BaCl2 = BaSO4↓ + 2NaCl
请根据以上信息,计算反应后所得溶液中溶质的质量分数。
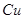 -
-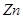 合金又称黄铜。为了测定某黄铜样品中铜的质量分数,取10g该黄铜样品加入到50g稀硫酸中,恰好完全反应,产生气体0.2g。试求:
合金又称黄铜。为了测定某黄铜样品中铜的质量分数,取10g该黄铜样品加入到50g稀硫酸中,恰好完全反应,产生气体0.2g。试求:
(1)该黄铜样品中锌的质量?
(2)该黄铜样品中铜的质量分数?
(3)原稀硫酸溶液中硫酸的溶质质量分数?
将铜和氧化铜固体混合物粉末11.2g放入烧杯中,当加入稀硫酸100 g时,氧化铜与硫酸恰好完全反应.过滤后所得溶液的质量为108g,(不考虑过滤过程中溶液的质量损失).
(1)混合物中铜元素的质量分数为 (计算结果保留到0.1%)
(2)求稀硫酸中H2SO4的质量分数.(写出计算过程)
将10g生锈的铁片放入100g稀盐酸中,恰好完全反应,放出气体的质量为0.2g,
试求:(1)铁片中单质铁的质量(2)铁片中铁锈的质量分数(3)最后所得溶液的质量
现有铜与另一种金属的混合物粉末,另一种金属可能是镁、铁、锌中的一种,现欲测定其组成.
【查阅资料】(1)镁、铁、锌皆能与稀硫酸发生置换反应,且生成+2价的可溶性金属硫酸盐和氢气.
(2)相对原子质量:Mg﹣24、Fe﹣56、Zn﹣65
【实验步骤及数据】取该混合物粉末8.0g放入烧杯中,将140.0g 14.0%的稀硫酸分四次加入该烧杯中,充分反应后,测得剩余固体质量数据记录如下:
| 次数 |
1 |
2 |
3 |
4 |
| 加入稀硫酸的质量/g |
35.O |
35.0 |
35.O |
35.O |
| 剩余固体的质量/g |
6.8 |
5.6 |
4.4 |
4.2 |
通过计算(写出计算过程),求:
(1)该混合物粉末中铜的质量分数?
(2)该混合物粉末中另一金属为何种金属?
(3)第三次加入硫酸充分反应后,所得溶液中溶质的质量分数是多少?
食盐是维持人体正常生理活动必不可少的物质。人体细胞中约含有NaCl 0.9 % ,一般成年人每日需NaCl的量为4.5 g~9 g。
(1)某病人因食盐摄入量不足,需要补充溶质质量分数约为0.9 % 的生理盐水,医生通过诊断需为他注射200 g生理盐水,则该病人每天可补充食盐约 g。
(2)若用50 g溶质质量分数为18%的氯化钠溶液配制溶质质量分数为0.9 % 的生理盐水,需加水____ g。正确计算后,若在量取水时,仰视读数,其他操作均正确,所得溶液的溶质质量分数会 0.9 %。(填“大于、小于、等于”)。
(3)小明想检验某瓶生理盐水的氯化钠含量是否合格,他从该瓶生理盐水中取出65 g溶液,然后加入足量硝酸银溶液(NaCl +AgNO3="=AgCl↓+" NaNO3),充分反应后过滤、洗涤、干燥,得到1.435 g沉淀。请你通过计算帮助小明判断这瓶生理盐水的氯化钠含量是否合格。(写出计算过程)
为了测定某稀硫酸的溶质质量分数,在10g稀硫酸中滴加过量的氯化钡溶液,得到沉淀2.33g,求该稀硫酸的溶质质量分数.
某工厂从1000kg铝土矿(主要成分是Al 2O 3)冶炼得到270kg铝。反应的化学方程式是:2Al 2O 3(熔融)  4Al+3O 2↑。请计算。
4Al+3O 2↑。请计算。
(1)Al 2O 3中,Al、O原子个数比是 。
(2)列式计算该铝土矿中Al 2O 3的质量分数。
某碳酸钾样品中混有少量氯化钾杂质,取一定量样品于烧杯中,向烧杯中加入100g质量分数为7.3%的稀盐酸,此时恰好完全反应,将所得溶液蒸干得到18.1g固体,计算样品中碳酸钾的质量分数?(计算结果精确到0.1%)
实验室常用双氧水和二氧化锰制取氧气,向102.2克双氧水中加入2克二氧化锰充分反应至不再产生气体为止,测得反应后装置中水的质量为99克。
(1)产生氧气的质量为 ;
(2)参加反应的过氧化氢质量是多少?(写出必要的计算过程)
(3)画出反应过程中装置里氢元素的质量与时间的关系图

某化学兴趣小组欲测定某石灰石样品中碳酸钙的质量分数.取25g石灰石样品(假设杂质既不溶于水,也不与其它物质反应),向其中加入146g一定溶质质量分数的稀盐酸,恰好完全反应,称得固液混合物的质量为162.2g。请回答下列问题:
(1)该样品中碳酸钙的质量分数为多少?
(2)向反应后的固液混合物中加入142.8g水,充分搅拌后过滤,所得溶液的溶质质量分数为多少?
(3)用36.5%的浓盐酸配制146g上述实验所用的稀盐酸,需要加水的质量为多少?
我州地处武陵山区,具有丰富的天然石灰石、大理石(主要成分是碳酸钙)资源,纯度高、硬度大,是优质的建筑材料.为测定某地天然大理石中碳酸钙的含量(杂质不与稀盐酸反应),某化学兴趣小组成员取25
样品,加入一定溶质质量分数的稀盐酸,测得的实验数据如图所示。

(1)求样品中碳酸钙的质量分数;
(2)所加稀盐酸的溶质质量分数.
溶液对过氧化氢的分解有催化作用。取溶质质量分数为8.5%的过氧化氢溶液
倒入小烧杯中,向其中加入溶质质量为
的
溶液
,使过氧化氢完全分解。试计算:
(1)产生氧气的质量;
(2)反应后所所得溶液中
的质量分数。
(9分)学习酸碱中和反应时,很多同学对其产生探究兴趣.
(1)甲同学将固体氢氧化钠放入装有稀硫酸的试管中并振荡,试管壁发烫,于是他得出酸碱中和反应是放热反应的结论.乙同学认为甲同学推理不合理,理由是 .
(2)配制40g10%的氢氧化钠溶液.
步骤为:计算、称取、量取、 、转移.量取水时如俯视读数,则配得的溶液溶质质量分数将 (选填“大于”“小于”“等于”)10%,最后将氢氧化钠溶液转移到试剂瓶中,贴上标签备用,在标签上可以不必注明的是 (填字母)
A.40g B.10% C.NaOH溶液
(3)乙同学为了验证甲同学的结论,将实验加以改进:将稀硫酸慢慢滴入装有40g10%氢氧化钠溶液的烧杯中,用温度计测出反应后溶液温度随加入稀硫酸质量的变化如图所示:
①B到C的过程中,烧杯内溶液中含有的阳离子有 (填离子符号);
②恰好完全反应时所得溶液中溶质质量分数.
某实验小组为测定氯酸钾样品中氯酸钾质量分数,取一定质量的该样品与7g二氧化锰混合,其总质量为32g.加热完全分解后剩余的固体质量为22.4g。(样品中的杂质不参与化学反应)
⑴完全反应后剩余固体的成分是______________________________
⑵样品中氯酸钾的质量分数是多少?
试题篮
()