农技人员采用“测土配方”技术对一片果园进行了土壤检测,结果显示该果园需要补充一定量的氮元素和钾元素。
(1)氮是植物生长的重要元素,果园土壤中缺少氮元素,需要用氮肥来补充,下列属于氮肥的是 (填序号)。
①KCl; ②NH4HCO3; ③Ca3(PO4)2。
(2)“测土配方”可以实现“缺什么、补什么”,使用该技术的好处是 。
(3)某同学取丰收牌钾肥(如图1)样品2.0g,溶于足量的水中,滴加过量氯化钡溶液,产生沉淀质量与所加氯化钡溶液质量的关系如图2。试通过计算判断该钾肥中硫酸钾的质量分数是否符合产品外包装说明?(反应方程式为:K2SO4+BaCl2=BaSO4↓+2KCl,杂质不参加反应。)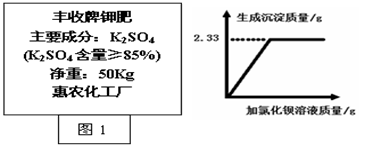
小强去商店买回一包纯碱,包装说明如右图.为测定该纯碱中碳酸钠含量是否符合标签要求,他称取了纯碱样品11g,全部溶解在50g水中,当加入稀盐酸64.4g时,恰好完全反应,所得溶液的质量为121g.试求:
(1)反应放出的CO2的质量为 g。
(2)纯碱样品中碳酸钠的质量。
(3)根据这一次检测,计算并判断样品中碳酸钠的含量是否符合标签要求。
阿斯匹林的主要成分是乙酰水杨酸(化学式为
),具有抑制血小板发挥作用的功能,是治疗心血管疾病的重要药物之一.
(1)乙酰水杨酸中氢、氧两种元素的质量比为.
(2)乙酰水杨酸具有酸性,若在其无色溶液中滴入紫色石蕊试液,观察到溶液呈色.
(3)人体内的血小板有何作用?。
新型材料纳米级
粉具有广泛的用途,它比普通
粉更易与氧气反应,其制备工艺流程如下图所示:
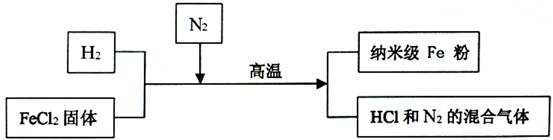
请回答下列问题:
(1)纳米级
粉在氧气中能自发燃烧生成黑色固体,此黑色固体的化学式为 。
(2)请补充完成上述制备工艺的化学方程式:
。 在制备纳米级
粉的工艺流程中,
的作用是。
(3)研究人员发现最后制得的纳米级
粉样品中混有少量的
杂质。
①为除去样品中的杂质,在无氧环境下,先加 溶解,然后再、洗涤、烘干.
②取样品20g,加入足量的盐酸,生成氢气0.7g。请计算该样品中单质
的质量分数。
(请写出计算过程)。
化学在防治大气污染和水污染等方面发挥了重要作用,使更多地化学生产工艺和产品向着环境友好的方向发展.
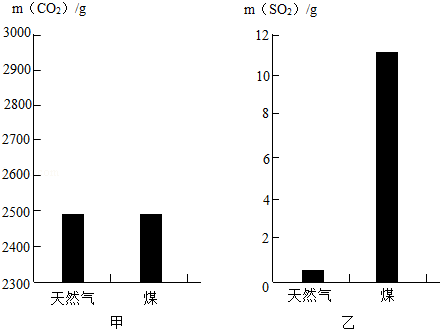
(1)为从源头消除污染,生产、生活中要选择对环境影响小的燃料,已知充分燃烧
天然气和煤所产生的
和
气体的质量如图所示,则燃烧产生的气体更易导致酸雨.
(2)某火力发电厂为了防止环境污染,需将废气中的二氧化硫进行处理,其发生的主要反应为
,若100
废气中含有1.6
二氧化硫,则处理1000
这种废气需含碳酸钙80%的石灰石
.
(3)某工厂以流量10
(升/秒)排出含硫酸9.8%的工业废水,现向该废水中排入含氢氧化钠2%的工业废水,与硫酸反应后再排出,要使处理后的废水呈中性,则含氢氧化钠2%的工业废水的流量应为
(上述含酸废水和含碱废水的密度均近似为
).
过氧乙酸是一种消毒剂.在2003年抗击"非典"的过程中发挥了巨大的作用.某医疗小组分队用溶质质量分数为0.5%的过氧乙酸溶液对环境进行消毒.
(1)过氧乙酸的化学式为
.过氧乙酸中碳、氢、氧元素的质量比为(填最简单整数比).
(2)要配制溶质质量分数为0.5%的过氧乙酸溶液600kg.需要溶质质量分数为15%的过氧乙酸溶液kg.
(3)配制的主要步骤是计算、量取、
黄铜是Cu和Zn的合金,可用于制造各种仪器零件。为测定黄铜的组成,课外活动小组的同学取黄铜样品10 g放入烧杯中,滴入稀硫酸至不再产生气泡时,测得消耗了稀硫酸30 g,烧杯中剩余固体质量6.1 g。请回答:
(1)测定过程中发生反应的化学方程式为:________________________________。
(2)烧杯中剩余固体的成分为________;黄铜样品中Cu的质量分数为________。
如图是实验室所用盐酸试剂瓶上标签的部分内容,请仔细阅读后计算:(1)用60mL的浓盐酸可以配制溶质质量分数为10%的盐酸 则他至少每天要喝多少毫升牛奶?
B:(第1,2小题各1分,第3小题2分)
(2)利用刚配好的盐酸测定某二价金属(R)的纯度:他取8克该不纯金属粉末(所含杂质不与酸反应,也不溶解于水)再取刚配好的盐酸溶液73克混合至恰好完全反应后过滤,将滤液蒸干,得到粉末状固体的质量为13.6克.
①金属R发生反应的化学方程式 ;
②利用已知条件求解反应生成氢气的质量(x)比例式 ;;
③该金属的纯度 ;
④若反应后的溶液只含有一种溶质,向反应后的溶液中加入56.7克水,则此时溶液中溶质质量分数 .
某化学兴趣小组为了测定一工厂废水中硫酸的含量,取100g废水于烧杯中,加入120g质量分数为10%的氢氧化钠溶液,恰好完全反应(废水中无不溶物,其它成份不与氢氧化钠反应)。请计算废水中硫酸的质量分数。
碘元素对人体健康起着重要的作用,在食盐中加碘可有效预防甲状腺肿大的发生。
如图是某品牌加碘盐的标签,请回答下列问题。
(1)写出碘酸钾中阳离子的符号 ,碘酸钾中K、I、O 三种元素的质量比为 。
(2)高温烹饪会使含碘量降低,说明碘酸钾的化学性质之一是 。
(3)根据有关数据估算,每 500g 该加碘食盐中碘酸钾(KIO3)的质量范围是 。(填字母序号)
A.15~30mg B.25~51mg C.60~120mg
汽车、电动车一般使用铅酸蓄电池。某铅酸蓄电池使用的酸溶液是质量分数为20%的稀硫酸。请回答下列有关问题:
(1)若用100g质量分数为98%的浓硫酸(密度为1.84g/cm3)配制该稀硫酸时,需要蒸馏水(密度为1g/cm3)的体积为ml(精确到0.1);
(2)该实验的主要步骤有计算、量取、稀释配制、装瓶并贴标签。请填写右侧的标签;

(3)用量筒量取浓硫酸时俯视读数,所配溶液溶质质量分数20%(填"大于"、"小于"或"等于")。
(7)向25.8g含有少量氯化钠杂质的碳酸钠白色固体中,慢慢加入10%的稀盐酸到恰好不在产生气体为止,共收集到气体8.8g。白色固体中碳酸钠的质量是多少?所得溶液中氯化钠的质量分数是多少?
加热条件下,下列物质在密闭容器内充分反应,测得反应前后各物质的质量如下:
| 物质 |
A |
B |
C |
D |
| 反应前质量/g |
0.6 |
3.8 |
1.0 |
0.6 |
| 反应后质量/g |
待测 |
1.0 |
4.4 |
0 |
该反应所属的基本反应类型是_______________;反应中A物质可能是_______ __。
我国约在南北朝时就开始冶炼黄铜。黄铜是铜和锌的合金(Cu-Zn),它可用来制造及其、电器零件及日用品。为了测定某黄铜样品中锌的质量分数(不考虑黄铜中的其他杂质),现将15mL稀盐酸分三次加入到5g黄铜样品粉末中,每次充分反应后,测定生成氢气的质量,实验数据见下表:试求:
| |
第一次 |
第二次 |
第三次 |
| 加入稀盐酸的体积(mL) |
5 |
5 |
5 |
| 生成氢气的质量(g) |
0.04 |
m |
0.02 |
(1)m= 。
(2)此黄铜样品中锌的质量分数是多少?
有一种牙膏侧面的标签如图:
(1)测得牙膏与水的混合物的pH为8, 则其呈 性(填“酸”、“中”或“碱”)。
(2)该支牙膏含氟元素的质量为 g。
(3)检验该牙膏中是否含有碳酸根离子的实验方法是 。
试题篮
()