某化工厂化验室用10%的氢氧化钠溶液洗涤一定量石油产品中的残余硫酸,共消耗氢
氧化钠溶液40g,洗涤后的溶液呈中性。这一定量石油产品中含H2SO4质量是多少?
现有一瓶久置的标有质量分数为10%的NaOH溶液样品,为探究其变质(NaOH易和空气中的CO2反应生成Na2CO3)的相关问题,利用U形管设计如下图所示的装置进行实验。
(1)如图甲所示,若此溶液变质,分别在U形管的两端滴入HCl溶液和澄清的石灰水时,观察到的现象:a端_____________________,b端___________________。
(2)如图乙所示,取此NaOH样品溶液20g放于U形管中,并在其中加入适量的酚酞试液,通过分液漏斗向U形管中滴入HCl溶液,当滴入20gHCl溶液时,恰好反应完全。
①滴入稀盐酸过程中,U形管中的溶液颜色变化为______________________________。
②恰好完全反应时,生产气体0.22g,试计算该溶液中Na2CO3的质量分数。
为了探究石灰石与稀盐酸反应制备二氧化碳后的废液中的溶质成分,将废液过滤,取滤液20克于烧杯中,在不断振荡的条件下,向其中滴加质量分数为10.6%的碳酸钠溶液直至过量,有关的变化如图所示:
根据题中有关信息和图像分析回答下列问题:
(1)原废液中的溶质成分有 (用化学式回答)。
(2)A点处溶液中溶质的质量是多少克?(通过计算回答)
葡萄糖溶液是将葡萄糖(化学式为:C6H12O6)溶于水形成的。某温度下一定质量的葡萄糖溶液中氢元素的质量分数为10%,则该溶液中碳元素的质量分数为( )
A.5%B.10%C.25%D.60%
(5分)某化学实验小组要测定一种纯碱样品中碳酸钠的含量,并用一定溶质质量分数的稀硫酸进行实验,记录实验数据如下(样品中杂质不含钠元素、不溶于水也不与硫酸反应)
| |
第一次 |
第二次 |
第三次 |
| 加入的稀硫酸的质量(g) |
100 |
100 |
100 |
| 加入的样品的质量(g) |
20 |
40 |
42 |
| 生成气体的质量(g) |
2.2 |
4.4 |
4.4 |
(1)写出实验中发生反应的化学方程式 ;
(2)根据已知条件列出求解第三次参加反应的纯碱的质量(x)的比例式 ;
(3)将第二次实验所得的溶液蒸发掉6.2g水,所得不饱和溶液中溶质的质量分数为 ;
(4)若配制实验中所用稀硫酸200g,需要用溶质质量分数为98%的浓硫酸的质量为 ;
(5)这种纯碱样品中碳酸钠的质量分数为 。
某物质的充分燃烧产物是CO2和H2O,为了确定该物质的元素组成,某小组设计了如下图所示实验(其中浓硫酸、无水CaCl2均为常用干燥剂,部分固定装置省略)。称取0.84g待测物完全燃烧后,称得D装置增重1.08 g,E装置增重2.64 g。则下列推断正确的是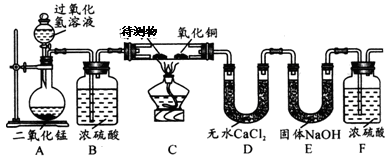
A.该物质一定含有C、H元素,没有氧元素
B.该物质一定含有C、H、O元素
C.用充有空气的储气球代替装置A、B更有利于实验的进行
D.氧化铜的有无对实验结果没有影响
现有一定质量的甲烷不完全燃烧,生成一氧化碳、二氧化碳和水蒸气的混合气体75g,经测定混合气体中碳元素的质量分数为16%,则参加反应的氧气的质量是
| A.48g | B.56g | C.59g | D.64g |
Fe2O3、CuO的固体混合粉末a g,高温下用足量氢气还原,得到金属混合物2.40 g,将生成的水用足量的浓硫酸吸收后,浓硫酸增重0.9克,则a的值为
| A.3.20 | B.3.30 | C.4.00 | D.4.20 |
有一含CaCO3与CaO的混合物,取该混合物16g,进行充分高温煅烧后,将剩余固体投入200g溶质质量分数为7.3%的稀盐酸中,恰好完全反应,则原混合物中钙元素的质量分数为
| A.30% | B.40% | C.50% | D.60% |
味精是常用的调味品,它的鲜味来自于其中的主要成分“谷氨酸钠”(化学式是C5H8NO4Na,易溶于水,与AgNO3不反应),另外还含有NaCl,其它成分不考虑。请回答下列问题:
(1)味精中至少含有 (填数字)种元素。
(2)称取5.0g味精配制成50g溶液,量取蒸馏水的量筒规格是 (填字母)。
A.5mL B.10mL C.50mL D.100mL
(3)如图是配制过程,正确的操作顺序为 (填字母)。
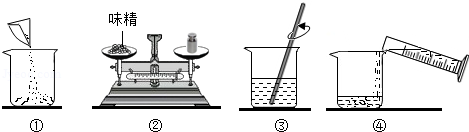
A.①②③④B.②①④③C.②④①③
(4)为测定NaCl在味精中的质量分数,进行如下实验:
①向所配制的50g溶液中加入AgNO3溶液充分反应,检验沉淀是否完全的方法是:静置后,在上层清液中加入 (填化学式)溶液,观察是否有沉淀生成。
②在其它操作均正确的情况下,若在配制溶液过程中,仰视刻度量取蒸馏水,则所配制溶液中,谷氨酸钠的质量分数 (填“偏大”、“偏小”或“无影响”),所测定的味精中NaCl的质量分数 (填“偏大”、“偏小”或“无影响”)。
③精确测定AgCl沉淀质量为2.87g,则该味精中NaCl的质量分数为 。(计算结果精确到0.1%.有关物质的相对分子质量:NaCl﹣58.5,AgCl﹣143.5 )
将Cu、CuO、Cu(OH)2的混合物12g加入到稀硫酸中,恰好完全反应后,过滤,得到含硫元素的3.2%的溶液50g和滤渣4g,则原混合物中Cu元素的质量分数为
| A.70% | B.60% | C.40% | D.33% |
尿素[CO(NH 2) 2]是氮肥中最主要的一种,其含氮量高,在土壤中不残留任何有害物质,长期施用没有不良影响。计算:
(1)CO(NH 2) 2中共含有 (写数字)种元素;
(2)CO(NH 2) 2的相对分子质量是 ;
(3)若CO(NH 2) 2中含有3g氮元素,则该CO(NH 2) 2的质量为 g(计算结果精确到0.1)。
Na 2S 2O 5(焦亚硫酸钠)、K 2S 2O 5(焦亚硫酸钾)等焦亚硫酸盐是常用的食品添加剂,现行国家食品安全标准规定:使用焦亚硫酸盐时,果酒中的残留量以SO 2计不得超过0.050g/kg。回答以下问题:
(1)Na 2S 2O 5的相对分子质量为 。
(2)若Na 2S 2O 5可改写为Na 2O•2SO 2,则K 2S 2O 5可改写为 。
(3)若制作果酒时使用了Na 2S 2O 5作添加剂,则合格的果酒中Na 2S 2O 5最大含量为 g/kg
“热重分析法(TG)”是利用程序控制温度测量物质质量与温度关系的一种技术。用TG法研究一水合草酸钙(CaC2O4•H2O)的热分解产物时,随温度升高依次发生如下反应:CaC2O4•H2O CaC2O4+H2O↑;CaC2O4
CaC2O4+H2O↑;CaC2O4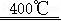 CaCO3+CO↑;CaCO3
CaCO3+CO↑;CaCO3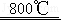 CaO+CO2↑现取29.2g CaC2O4•H2O,用TG法加热一段时间后冷却,测得剩余固体中钙的质量分数为33.7%.下列关于剩余固体成分的判断中正确的是( )
CaO+CO2↑现取29.2g CaC2O4•H2O,用TG法加热一段时间后冷却,测得剩余固体中钙的质量分数为33.7%.下列关于剩余固体成分的判断中正确的是( )
A.只有CaC2O4B.CaC2O4•H2O和CaCO3
C.CaCO3和CaOD.CaC2O4和CaCO3
马英同学取某地石灰石样品
进行测定实验,现将
稀盐酸分五次加入石灰石样品中(杂质不溶于水也不参与反应),充分反应后测得生成气体的总质量如下表所示:
| 第1次 |
第2次 |
第3次 |
第4次 |
第5次 |
|
| 加入稀盐酸的质量 | |||||
| 生成气体的总质量
|
试求:
(1)
的值为
(2) 石灰石样品中碳酸钙的质量等于
(3)反应完全后最终溶液中氯化钙的质量分数?(写出计算过程,计算结果精确至0.1)
试题篮
()