处理照相胶片的废液中含有大量Ag+、Zn2+、Fe2+,某同学欲从上述废液中回收银,并得到副产品硫酸亚铁,设计如下操作流程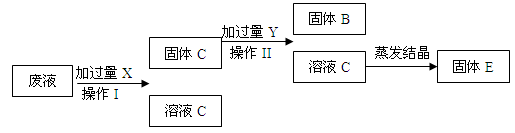
请回答:操作I的名称是 ,回收的银在 (填字母)中,X的化学式为 ,Y的化学式为 。
某金属加工厂有大量金属铝、铁、铜的废弃粉末,为充分利用金属资源,分离
和回收金属,某化学兴趣小组通过查阅资料设计了如下实验方案:
请完成下列各题:
(1)步骤①中分离得到的金属B是 。
(2)步骤②中所需的主要操作是 。
(3)步骤③生成沉淀的化学反应方程式是 ;
因Al(OH)3既能与酸反应又能与碱反应,步骤③逐滴加入试剂至 为止。
(4)电解熔融Al2O3制金属铝的化学方程式是 。
根据下图四个化学实验,回答问题:(提示:Cu与Zn的合金称为黄铜)
(1)描述实验a中的实验现象 。
(2)要证明Cu、Zn、Ag的活动性顺序,必须要做的实验是 (填实验序号)。
(3)在c实验后的剩余溶液中,一定有的溶质是 ,可能有的溶质是 ,为了确定可能有的溶质,可加入 (填选项序号)
Ⅰ.氯化钡溶液 Ⅱ.氢氧化铜 Ⅲ.氢氧化钠溶液 Ⅳ.锌粒
(4)为了测定d中稀硫酸的溶质质量分数,取20g该黄铜样品于烧杯中,向其中分4次加入该稀硫酸,充分反应。每次所用稀硫酸的质量及剩余固体的质量记录于下表:
| |
加入稀硫酸的质量(g) |
充分反应后剩余固体的质量(g) |
| 第1次 |
25 |
16.75 |
| 第2次 |
25 |
13.5 |
| 第3次 |
25 |
m |
| 第4次 |
25 |
12.0 |
试回答下列问题:
Ⅰ.上述表格中m的值为 ;
Ⅱ.该稀硫酸的溶质质量分数是多少?(根据化学方程式计算)
化学兴趣小组的同学们探究用
从含
和
的溶液中获取金属
的原理.请你一起参与探究.
(1)实验依据:金属活动顺序.请在下表对应的方框内填入铁和铜的元素符号.

(2)意外发现:小明将光亮的铁丝插入含
和
的废液中,一段时间后取出,意外地发现铁丝表面没有变红.
(3)提出问题:
为什么没有从废液中置换出
?
(4)提出假设:小丽认为在铁丝表面可能有
析出,但被
溶液溶解了.
(5)验证假设:提供的主要实验用品:洁净的铁丝和铜丝各两根,相同体积、相同浓度的
溶液三份[
溶液显黄色].
| 实验操作 |
实验现象和数据 |
结论 |
| ①准确称量洁净的铁丝和铜丝的质量 |
铁丝质量为ag, 铜丝质量为bg |
\ |
| ②将铁丝插入
溶液中,一段时间后取出、洗净、干燥、称量 |
铁丝质量为mg,(m<a),溶液有黄色变为浅绿色 |
一定有生成(填化学式) |
| ③将铜丝插入
溶液中,一段时间后取出、洗净、干燥、称量 |
铜丝质量为ng(n<b) |
铜(填"能"或"不能")与
溶液反应 |
| ④另取相同质量、相同粗细的洁净铁丝和铜丝互相缠绕,插入
溶液中,一段时间后取出、洗净、干燥、分别称量铁丝和铜丝的质量 |
铁丝质量较轻 铜丝质量不变 |
Fe、
共存时优先与
溶液反应 |
(6)实验结论:小丽的假设(选填"成立"或"不成立"),理由是;
(7)思考与交流:
①兴趣小组的同学们通过对上述实验的分析,找到了用
从含
和
的溶液中提取金属
的关键,并且最终实验获得了成功,其实验成功的关键是:.并且反应充分.
②已知
和
发生化合反应.请按反应顺序写出用
从含
和
的溶液中获取金属
的化学方程式:;.
勇往直前学习活动小组的同学正在做一个探究实验,他们准备了以下实验用品:铁
架台、干燥洁净的几支试管、洁净无锈的4枚铁钉、植物油、久置的蒸馏水、胶塞、棉花和干燥剂氯化钙,还可以选用其他物品。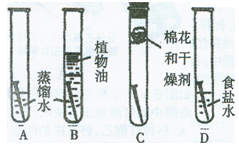
【分析思考】他们探究的问题是(1)_______________;
【实验准备】小冰检查实验用品时,发现有一种不符合实验要求,请你写出这种用品(2)_________________,
并提出你的解决办法(3)_________________________;
【实验观察】一切用品按要求准备就绪,同学们按照图
示进行了探究实验,B中植物油的作用是(4)________
________________________________________________,10天后,他们会观察
到的实验现象是(5)_________________________________________________。
【实验总结】铁生锈的条件是(6)_____________________________________。
【实验拓展】爱思考勤实践的小城补充了D试管中的实验,发现这只试管中的
铁钉锈蚀最严重,根据此实验和学过的金属的化学性质,小城知道,使用铁制
品时,要尽量避免与(7)___________物质接触;
【实验感悟】金属的锈蚀每时每刻都在发生着,金属的防护刻不容缓!
向AgNO3溶液中加入一定量的Al和Fe的混合粉末,充分反应后过滤,得到滤渣和浅绿色滤液。关于该滤渣和滤液有下列四种说法:
①向滤渣中加入稀盐酸,一定有气泡产生。
②向滤液中加入稀盐酸,可能有气泡产生。
③滤渣中一定含有银。
④滤液中一定含有Fe(NO3)2,一定不含AgNO3,可能含有Al(NO3)3
其中正确的说法有( )
| A.①② | B.②③ | C.③④ | D.②③④ |
铁及其化合物在生活生产中有重要的应用。请回答下列问题:
(1)铁制品在空气中易锈蚀,其实质是铁与空气中的氧气、 等接触后发生化学反应的过程。
(2)在盛有氧气的集气瓶中点燃细铁丝发生剧烈燃烧的化学方程式是 。为防止集气瓶破裂,常采取的措施是 。
(3)把铁粉和铜粉的混合物放入硝酸银溶液中,充分反应后,过滤,为确定滤渣和滤液的成分,甲同学向滤渣中滴加稀盐酸,无气泡产生; 乙同学向滤液中滴加稀盐酸,产生白色沉淀。根据两同学实验的现象,分析下列结论不正确的是 (填写字母序号)。
A.滤渣中只含银 B.滤渣中一定含有银,可能含有铜
C.滤液中一定有Ag+ 、Fe2+ 和Cu2+ D.滤液中只含Ag+ 和Fe2+,不含Cu2+
【探究】废旧金属的回收利用。
废铁屑的主要成份是铁,同时还有少量铁锈(Fe2O3),生产动物饲料添加剂硫酸亚铁的工艺之一如下图所示: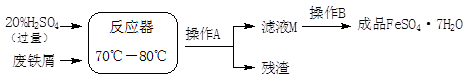
(4)在反应器中发生反应的化学方程式有:
Fe + H2SO4 =FeSO4 +H2↑、 、 Fe2(SO4)3 + Fe = 3FeSO4。
(5)滤液M中肯定含有的溶质的化学式是 ;
(6)在化学反应中,凡是有元素化合价变化的反应属于氧化还原反应。下列反应类型肯定属于氧化还原反应的是 (填字母编号);
A.化合反应 B.置换反应 C.分解反应 D.复分解反应
(7)取表面含有氧化镁的镁条(无其它杂质)2.5g,加入到足量的20.0g的稀硫酸中,充分反应后,所得溶液的质量为22.3g。求:该镁条中单质镁的质量分数。
将质量相等的A、B、C三种金属,同时分别放入三份质量分数相同且足量的的稀盐酸中,反应生成的H2质量与时间关系如图,得出结论正确的是(已知A、B、C在生成物中均为+2价)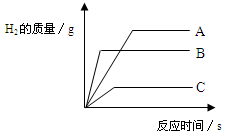
A.金属的活动性顺序A﹥B﹥C
B.生成H2的质量C﹥B﹥A
C.相对原子质量C﹥B﹥A
D.反应速率最大的是A
(本题7分)某校化学兴趣小组经查阅资料得知:铝是重要的轻金属,广泛应用于航空、电讯和建筑等领域。铝也有其特殊的性质:①铝的熔点是660℃,氧化铝的熔点高达2054℃。②铝虽比锌活泼,但是将铝和锌分别投入稀硫酸中,铝比锌反应慢得多。③尽管铝表面致密的氧化膜能使铝与其周围的介质(空气、水)隔绝,但“奇怪”的是铝制容器仍不能用来盛放和腌制咸菜。为此该小组进行了“铝表面氧化膜”的探究实验,其过程如下,请完成填空:
【实验1】用坩埚钳夹住一块擦去氧化膜的铝片,放在酒精灯火焰上灼烧,铝片表面接触火焰的部分变暗片刻后变软;轻轻摇动,会左右摇晃,却不像蜡烛那样滴落。
问题:
(1)请写出在空气中灼烧铝片的化学方程式 ;
(2)铝片接触火焰的部分不像蜡烛那样滴落的原因是 。
【实验2】取2条未用砂纸打磨过的铝片,一片浸入CuCl2稀溶液中,其表面很快析出较多红色粉末状固体;而另一片浸入CuSO4稀溶液中现象一直不明显。
问题:试猜测产生这种现象差异的因素是
【实验3】用砂纸打磨一铝片使其表面较粗糙,再将其放入CuSO4稀溶液中,直到2-3分钟后,铝片表面才有少量红色固体附着。
问题:试写出铝片表面附着红色固体的化学方程式: ;
【实验4】向实验2的CuSO4稀溶液中滴入3-5滴NaCl稀溶液,铝片表面逐渐有红色固体析出。
【实验5】向实验2的CuSO4稀溶液中滴入3-5滴Na2SO4稀溶液,铝片表面现象一直不明显。
问题:根据实验2、3、4、5的现象可以得出的结论是 。
现有镁、铝两种金属分别与稀盐酸充分反应,生成相同质量的氢气,则可能的情况有
| A.等质量的镁、铝分别与足量的稀盐酸充分反应 |
| B.质量比为4︰3的镁、铝分别与足量的稀盐酸充分反应 |
| C.质量比为8︰9的镁、铝分别与足量的稀盐酸充分反应 |
| D.足量的镁、铝分别与等质量、等浓度的稀盐酸充分反应 |
小明为探究金属与盐的反应,将一定质量的某种金属M的粉末放入 与 的混合溶液中,充分反应后发现,溶液呈现无色,溶液底部有少量固体粉末;过滤后在滤渣和滤液中分别加入适量稀盐酸,滤渣中有无色气体产生,滤液中无沉淀产生。结合实际现象判断,小明得出的以下结论错误的是( )
| A. | 滤液中一定没有银离子 |
| B. | 滤渣中一定含有金属单质M |
| C. | 滤渣中一定含有单质铜 |
| D. | 加入的金属M可能是单质铁 |
5.6g铁样品,溶解在足量的稀盐酸中生成0.2g氢气,下列说法正确的是
| A.该样品一定是纯净物 |
| B.该样品一定含有镁、铝两种杂质 |
| C.该样品一定是混合物 |
| D.该样品可能含有锌和镁两种杂质 |
以下是甲、乙两同学对有关镁与盐酸反应的系列研究。
研究一:镁与盐酸反应过程中的能量变化以及反应速率的变化:
(1)反应中试管外壁发烫,说明镁与稀盐酸反应是 反应(填
“吸热”或“放热”)。
(2)实验测得镁片产生气体的速率(v)与时间(t)的关系如图所示,
则t1~t2时间内反应速率逐渐加快的主要原因是 。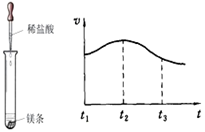
研究二:反应后所得溶液的酸碱性探究:
(3)甲同学反应后用pH试纸测定试管中溶液的酸碱性,发现pH小于7,说明甲同学所得溶
液呈 性(选填“酸”“碱”或“中”)。
甲同学:猜想Ⅰ:稀盐酸过量,使溶液pH小于7;猜想Ⅱ:氯化镁溶液pH小于7。为
验证猜想,甲同学需测定 溶液的酸碱性,实验表明该溶液显弱酸性。
(4)乙同学重复甲同学实验时,发现反应后所得试管中溶液pH大于7。发现实验与甲同学实
验不同的是,反应后的试管中镁条有剩余。乙同学猜想可能是镁与热水反应生成了碱性
物质。乙同学为验证猜想,在滴有两滴酚酞的热水中放入一段打磨过的镁条,观察到溶
液很快变为红色,同时还观察到镁条表面有气体生成,收集并点燃该气体,发现能燃烧,
请根据实验现象写出镁与水反应的化学反应方程式 。
(5)金属氯化物溶液pH值大小与金属的活动性有关,如氯化钠溶液显中性,氯化镁溶液显弱酸性,则氯化钾溶液显 性。
(6)活泼金属能与水在一定条件下反应。实验发现钠与冷水剧烈反应,产生大量的气体。由
此可见金属与水反应与金属的活动性顺序 (填“有关”或“无关”)。
研究三:金属活动性强弱与原子结构的关系:
下图为镁原子、钙原子和钡原子结构示意图。已知其中Ba的活动性最强,据此推测,金属的活动性除与原子的最外层电子数有关,还与 有关。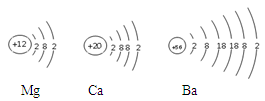
研究四:确定镁条的成分:
称取3.2g表面被氧化的镁条, 放入100g稀盐酸中恰好完全反应,生成气体0.2g。求:
(7)此镁条中金属镁的质量。(写出计算过程,共3分)
(8)反应后所得溶液中溶质的质量分数 。(计算结果保留一位小数)
废旧金属可以回收利用,用合金废料(含
)制取
和
溶液的实验流程如图(部分生成物已略):

(1)合金属于(填"纯净物"或"混合物");
(2)步骤①反应的化学方程式为:
↑,依据质量守恒定律推出
的化学式为,步骤②反应的化学方程式为;
(3)由
制取
溶液有以下三种途径:
I.
↑
Ⅱ.
O
Ⅲ.
↑
你认为最佳途径是(填序号),理由是.
试题篮
()