在实验课中,各小组作了如下实验:
| 实验编号 |
1 |
2 |
3 |
4 |
| 实验操作 |
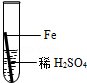 |
 |
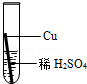 |
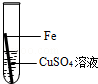 |
实验后,同学们按老师要求将废液都倒在指定的大烧杯中,小科猜想该烧杯中的废液可能有硫酸铜、硫酸锌、硫酸亚铁…,应该可以从中提炼出铁和铜.经思考后,他设计了如图所示的实验,并设法使滤液甲和乙所含的溶质相同.
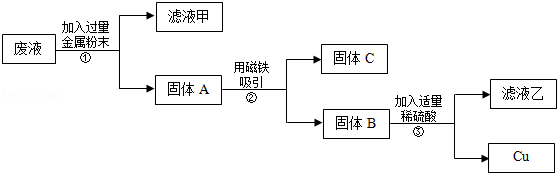
则固体C是,操作③的名称是,实验中所加的过量金属粉末是.
处理照相胶片的废液中含有大量Ag+、Zn2+、Fe2+,某同学欲从上述废液中回收银,并得到副产品硫酸亚铁,设计如下操作流程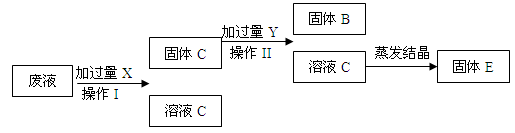
请回答:操作I的名称是 ,回收的银在 (填字母)中,X的化学式为 ,Y的化学式为 。
小明为探究金属与盐的反应,将一定质量的某种金属M的粉末放入 与 的混合溶液中,充分反应后发现,溶液呈现无色,溶液底部有少量固体粉末;过滤后在滤渣和滤液中分别加入适量稀盐酸,滤渣中有无色气体产生,滤液中无沉淀产生。结合实际现象判断,小明得出的以下结论错误的是( )
| A. | 滤液中一定没有银离子 |
| B. | 滤渣中一定含有金属单质M |
| C. | 滤渣中一定含有单质铜 |
| D. | 加入的金属M可能是单质铁 |
铁及其化合物在生活生产中有重要的应用。请回答下列问题:
(1)铁制品在空气中易锈蚀,其实质是铁与空气中的氧气、 等接触后发生化学反应的过程。
(2)在盛有氧气的集气瓶中点燃细铁丝发生剧烈燃烧的化学方程式是 。为防止集气瓶破裂,常采取的措施是 。
(3)把铁粉和铜粉的混合物放入硝酸银溶液中,充分反应后,过滤,为确定滤渣和滤液的成分,甲同学向滤渣中滴加稀盐酸,无气泡产生; 乙同学向滤液中滴加稀盐酸,产生白色沉淀。根据两同学实验的现象,分析下列结论不正确的是 (填写字母序号)。
A.滤渣中只含银 B.滤渣中一定含有银,可能含有铜
C.滤液中一定有Ag+ 、Fe2+ 和Cu2+ D.滤液中只含Ag+ 和Fe2+,不含Cu2+
【探究】废旧金属的回收利用。
废铁屑的主要成份是铁,同时还有少量铁锈(Fe2O3),生产动物饲料添加剂硫酸亚铁的工艺之一如下图所示: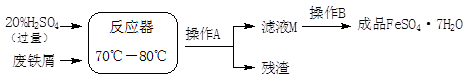
(4)在反应器中发生反应的化学方程式有:
Fe + H2SO4 =FeSO4 +H2↑、 、 Fe2(SO4)3 + Fe = 3FeSO4。
(5)滤液M中肯定含有的溶质的化学式是 ;
(6)在化学反应中,凡是有元素化合价变化的反应属于氧化还原反应。下列反应类型肯定属于氧化还原反应的是 (填字母编号);
A.化合反应 B.置换反应 C.分解反应 D.复分解反应
(7)取表面含有氧化镁的镁条(无其它杂质)2.5g,加入到足量的20.0g的稀硫酸中,充分反应后,所得溶液的质量为22.3g。求:该镁条中单质镁的质量分数。
(本题7分)某校化学兴趣小组经查阅资料得知:铝是重要的轻金属,广泛应用于航空、电讯和建筑等领域。铝也有其特殊的性质:①铝的熔点是660℃,氧化铝的熔点高达2054℃。②铝虽比锌活泼,但是将铝和锌分别投入稀硫酸中,铝比锌反应慢得多。③尽管铝表面致密的氧化膜能使铝与其周围的介质(空气、水)隔绝,但“奇怪”的是铝制容器仍不能用来盛放和腌制咸菜。为此该小组进行了“铝表面氧化膜”的探究实验,其过程如下,请完成填空:
【实验1】用坩埚钳夹住一块擦去氧化膜的铝片,放在酒精灯火焰上灼烧,铝片表面接触火焰的部分变暗片刻后变软;轻轻摇动,会左右摇晃,却不像蜡烛那样滴落。
问题:
(1)请写出在空气中灼烧铝片的化学方程式 ;
(2)铝片接触火焰的部分不像蜡烛那样滴落的原因是 。
【实验2】取2条未用砂纸打磨过的铝片,一片浸入CuCl2稀溶液中,其表面很快析出较多红色粉末状固体;而另一片浸入CuSO4稀溶液中现象一直不明显。
问题:试猜测产生这种现象差异的因素是
【实验3】用砂纸打磨一铝片使其表面较粗糙,再将其放入CuSO4稀溶液中,直到2-3分钟后,铝片表面才有少量红色固体附着。
问题:试写出铝片表面附着红色固体的化学方程式: ;
【实验4】向实验2的CuSO4稀溶液中滴入3-5滴NaCl稀溶液,铝片表面逐渐有红色固体析出。
【实验5】向实验2的CuSO4稀溶液中滴入3-5滴Na2SO4稀溶液,铝片表面现象一直不明显。
问题:根据实验2、3、4、5的现象可以得出的结论是 。
下列图像与所对应操作相符的是.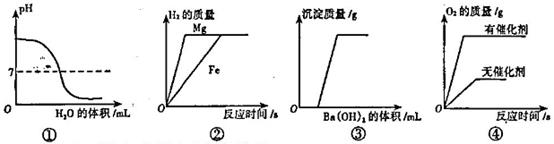
| A.①是对氢氧化钠溶液加水稀释 |
| B.②是将镁片和铁片(均足量)分别和等质量、等溶质质量分数的稀硫酸混合 |
| C.③是向HCI与Na2 SO4泥合溶液中加入Ba (OH)2溶液 |
| D.④是用等质量、等浓度的双氧水分别制取氧气 |
向一定量硝酸银和硝酸亚铁的混合溶液中加入锌粉,充分反应后所得溶液的质量与加入锌粉的质量关系如图。下列说法正确的是
| A.a点所得固体为银和铁 |
| B.b点所得溶液中的溶质为硝酸银、硝酸亚铁和硝酸锌 |
| C.c点所得固体为银、铁和锌 |
| D.d点所得溶液中的溶质为硝酸锌 |
一定质量的锌、铁分别和等质量、等浓度的盐酸反应,产生氢气质量与时间的关系如图所示,下列说法正确的是
| A.t1时,产生氢气的质量锌比铁小 |
| B.t1时,产生氢气的速率铁比锌大 |
| C.t2时,参加反应锌的质量与铁相同 |
| D.t2时,锌、铁消耗的盐酸质量相同 |
现有一种固体粉末状样品,已知该样品由氧化铜和铁组成。取样品少许,加入一定量的稀硫酸,待反应停止后过滤,得到滤渣和滤液。向滤液中加入一根洁净的铁丝,铁丝表面无明显变化。关于该实验有如下说法,其中错误的有几个
① 该样品的颜色为黑色;
② 向样品中加入稀硫酸后,一定有气体生成,且液体颜色不变;
③ 滤渣中一定有铜,不一定有铁;
④ 滤液中含有硫酸铜和硫酸亚铁;
⑤ 滤液中溶质只有硫酸铁。
| A.2个 | B.3个 | C.4个 | D.5个 |
某溶液含有Cu(NO3)2和AgNO3,现向其中加入一定量的锌粉,参加反应的锌的质量与溶液中金属离子种类的关系如图所示。下列说法不正确的是
| A.a~b间(不含两点)的溶液中金属离子为Zn2+、Ag+、Cu2+ |
| B.c~d间(不含两点)的溶液中金属离子为Zn2+、Cu2+ |
| C.当参加反应的锌的质量为m3时,溶液中金属离子为Zn2+ |
| D.当参加反应的锌的质量分别为m1、m2时,溶液中Cu(NO3)2的质量分数相等 |
金属材料与人类的生产和生活密切相关。请回答:
(1)下列用品中,主要利用金属导电性的是(填字母)
A.铂金饰品 B.铁锅 C.铝导线
(2)为了验证铝、铜、银三种金属的活动性顺序,设计了下列四种方案,其中可行的是(填 序号)
①将铝、银分别浸入到硫酸铜溶液中
②将银分别浸入到硫酸铝、硫酸铜溶液中
③将铜、银分别浸入到硫酸铝溶液中
④将铜分别浸入到硫酸铝、硝酸银溶液中
(3)在氯化铜和氯化亚铁的混合溶液中加入一定质量的镁粉,充分反应后过滤,得到滤渣和滤液。
①滤液中一定含有的溶质是(填化学式);
②向滤渣中滴加稀盐酸,有气泡产生,则滤渣中一定含有的物质是(填化学式)。
(4)某钢铁厂每天需消耗4900t含
76%的赤铁矿石,该厂理论上可日产含
98%的生铁的质量是t。
(5分)Ti是一种重要的航天金属材料。某学习小组对三种金属Ti、Al、Cu的金属活动性顺序进行探究。过程如下:
【提出假设】a.Ti金属活动性比Al强。 b.Al金属活动性比Cu强。
【查阅资料】钛能与盐酸反应。
【实验设计】同温下,取大小相同的这三种金属薄片,分别投入等体积等浓度的足量的稀盐酸中反应,观察现象。
【操作分析】三种金属加入盐酸前都先用砂布将表面擦光亮,其目的是 。
A.除去氧化膜,利于直接反应
B.使表面光亮,易观察现象
C.使反应金属温度相同,易反应
【实验现象】
| 金 属 |
Ti |
Al |
Cu |
| 与盐酸反应现象 |
反应缓慢 |
反应剧烈 |
无明显现象 |
【实验结论】(1)原假设中 不正确(填“a”、“b”或“a与b”)。
(2)三种金属的金属活动性由强至弱的顺序为 。
【结论应用】能否用铝制容器来盛装波尔多液(含硫酸铜), (填“能”或“否”);理由是 。
在硫酸铜溶液中加入一定量的锌粉和铁粉充分反应后,过滤可得到一些固体.向该固体中加入少量稀硫酸,可观察到有气体产生.下列对该固体的叙述正确的是
①一定有锌、②一定有铁、③一定有铜、④可能有锌、⑤可能有铁、⑥可能有铜.
| A.①、②、③ | B.②、③、④ | C.③、④、⑤ | D.①、②、⑥ |
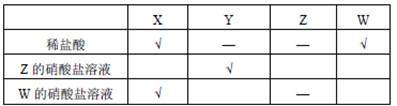
小明为了比较 、 、 、 四种金属的活动性顺序,利用这四种金属单质、稀盐酸、 的硝酸盐溶液和 的硝酸盐溶液,进行有关实验,结果如下表("√"表示能反应,"-"表示不能反应,"空白"表示未做该实验)。请你判断四种金属的活动性顺序为()
| A. | B. | C. | D. |
金属活动顺序在工农业生产和科学研究中有重要应用
(1)铝比较活泼,为什么铝制品却有较好的搞腐蚀性能?
(2)农业上不能用铁制容器配制波尔多液(含硫酸铜),请用化学方程式解释。
(3)探究实验:分别将不同量的锌粉加入一定量的
。混合溶液中,充分反应后过滤。以下是不同情况下对固体或滤液成分的探究。
①若向所得固体上滴加盐酸有气泡产生,则该固体含有金属为 。
②猜想:滤液中溶质为
,请分析猜想不合理的原因。
试题篮
()