欲测定一瓶标签破损的稀硫酸的溶质质量分数,现取30g稀硫酸样品于烧杯中,将15%的NaOH溶液逐滴加入烧杯中,边加边搅拌,随着NaOH溶液的不断加入,溶液pH的变化如图所示。回答下列问题:
(1)a点溶液中的溶质是 (填化学式)。
(2)计算该稀硫酸的溶质质量分数。(写出计算过程,结果精确到0.1%)

某石灰水中含有氢氧化钙1.48g,要使该石灰水中的氢氧化钙转化为碳酸钙沉淀,至少需要二氧化碳的质量是多少?
白铜(Cu﹣Ni)是工业上常用的一种合金,金属镍(Ni)的金属活泼性与铁相似,且化合价显+2价。为测定20g某白铜样品中镍的质量,设计了如下实验:

试问:
(1)将白铜研碎的目的是 。
(2)白铜样品中镍的质量 g。
(3)所用稀硫酸中溶质的质量分数(写出计算过程)。
欲测定一瓶标签破损的硫酸铜溶液的溶质质量分数,现取50g硫酸铜溶液样品于烧杯中,逐滴加入10%的NaOH溶液。生成沉淀的质量与加入NaOH溶液的质量之间的关系如图所示。回答下列问题:
(1)图中x= 。
(2)计算硫酸铜溶液的溶质质量分数。(写出计算过程)

某品牌补钙剂的主要成分是碳酸钙,实验小组的同学取该补钙剂2.5g,加入溶质质量分数为7.3%的稀盐酸至不再有气泡产生,共收集到二氧化碳0.88g(补钙剂中其他成分均不与稀盐酸反应)。请计算。
(1)该补钙剂中碳酸钙的质量分数。
(2)所用稀盐酸的质量。
我市覃塘区石灰石资源丰富,某石灰厂为了测定某石灰石样品中CaCO3的质量分数,往盛有300g稀盐酸的烧杯中依次加入粉碎后的石灰石样品(杂质不与盐酸反应),充分反应后,实验数据记录如表:
实验次数 |
第一次 |
第二次 |
第三次 |
石灰石样品/g |
25 |
15 |
10 |
烧杯中物质总质量/g |
316.2 |
326.8 |
m |
请回答:
(1)CaCO3中钙、碳、氧三种元素的质量比为 ;(写最简比)
(2)表中m= ;
(3)所用稀盐酸的溶质质量分数为 ;
(4)求该石灰石样品中CaCO3的质量分数。(写出计算过程)
"蛟龙号"是我国研制出的大深度载人潜水器。为保证载人潜水器长时间潜水,需要在潜水器里配备供氧装置。过氧化物供氧是一种常见的供氧技术,原理是用过氧化钠(化学式为Na 2O 2)固体常温下与二氧化碳反应,生成碳酸钠和氧气。若用这种方法制取96g氧气,则至少需要多少克过氧化钠?
某化学兴趣小组欲测定某石灰石样品中碳酸钙的质量分数,先将10g样品放入烧杯中,再把100g稀盐酸分5次加入该样品中(该实验条件下,杂质不与酸反应,也不溶解于水,忽略稀盐酸挥发),得实验数据如表格。
稀盐酸的质量 |
充分反应后剩固体的质量 |
第一次加入20g |
8g |
第二次加入20g |
6g |
第三次加入20g |
4g |
第四次加入20g |
2g |
第五次加入20g |
2g |
请计算;
(1)10g石灰石样品中碳酸钙的质量分数是 。
(2)求稀盐酸的溶质质量分数(写出计算过程,结果精确到0.1%)。
孔雀石的主要成分是Cu2(OH)2CO3,还含有Fe2O3、Al2O3、SiO2杂质,用该矿石制备Cu的流程如图所示(部分产物略去):
 (1)过程①中,操作a是溶解和 ,还有一种气体产物是 ,滤液X中含有的金属阳离子为 。
(1)过程①中,操作a是溶解和 ,还有一种气体产物是 ,滤液X中含有的金属阳离子为 。
(2)过程①中硫酸略过量,则过程②调pH除杂的最佳试剂是 (选填“CuO”或“Na2CO3”)。
(3)下列关于制取铜的两种方案的说法,正确的是 。
A.“方案一”得到的铜产品更纯
B.“方案一”不存在消耗能量的问题
C.“方案二”需考虑废气污染的问题
D.“方案二”得到纯铜的产率更高
(4)过程③发生的反应:2CuSO4+2H2O 2Cu+O2↑+ (补充完方程式),当收集到800t氧气时,产生Cu的质量是多少?(写出必要的计算过程)
2Cu+O2↑+ (补充完方程式),当收集到800t氧气时,产生Cu的质量是多少?(写出必要的计算过程)
烧杯中盛有锌粉和铁粉的混合物mg,向其中逐渐加入一定浓度的稀盐酸,测得剩余固体的质量与加入稀盐酸的体积的关系如图所示。下列有关结论正确的是( )
①加入V1mL稀盐酸时,剩余固体中不含锌
②加入V2mL稀盐酸时,溶液中的溶质为FeCl3和ZnCl2
③整个过程中发生反应均为置换反应
④反应中产生氢气的质量一定小于 g
g
⑤剩余固体质量m、n与稀盐酸的体积V1、V2的数量关系为 =
=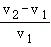

A.①②③④B.①③④C.①③⑤D.①③④⑤
钙是生物体骨骼的重要组成元素。鱼骨中含有碳酸钙,现设计图甲实验测定鱼骨中的碳酸钙含量,并将测得的数据绘制成图乙。

提示①食醋的主要成分是醋酸(HAc)。醋酸和碳酸钙反应的化学方程式为CaCO3+2HAc═CaAc2+H2O+CO2
②鱼骨中其它成分与食醋反应生成的气体可忽略不计
(1)该实验中浓硫酸的作用是 。
(2)由图乙中的AB曲线,可知锥形瓶中反应速率的变化情况是 (选填“变大”、“变小”或“不变)。
(3)根据图中的数据计算鱼骨中碳酸钙的质量分数。
(4)生活中,用喝醋的方法除去卡在咽上的鱼刺,这种做法是不科学的。请你结合实验结果加以说明 。
用沉淀法可测定食用碱样品中碳酸钠的质量分数。取11g食用碱样品(有少量的杂质氯化钠),加水完全溶解制成100g溶液,逐次滴加溶质质量分数相同的氯化钙溶液,实验数据如表:
实验次数 |
第1次 |
第2次 |
第3次 |
第4次 |
第5次 |
第6次 |
加入CaCl2溶液的质量/g |
20.0 |
20.0 |
20.0 |
20.0 |
20.0 |
20.0 |
反应后溶液的总质量/g |
118.0 |
136.0 |
154.0 |
M |
191.0 |
211.0 |
请根据实验数据分析解答下列问题:
(1)表中数据M的值为 。
(2)请画出生成沉淀的质量随滴加氯化钙溶液质量的变化关系图(标明恰好反应时点的坐标)。
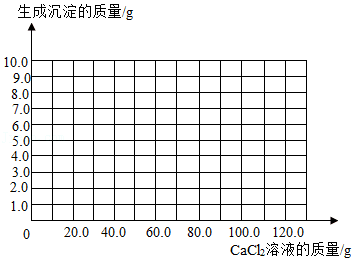
(3)计算该食用碱样品中碳酸钠的质量分数(写出过程,结果保留到0.1%)。
将50.0g盐酸、氯化镁和氯化铝的混合溶液置于烧杯中,逐滴加入质量分数为20.0%的氢氧化钠溶液,生成氢氧化铝沉淀的最大质量为7.8g。加入氢氧化钠溶液质量和生成沉淀质量的关系如图所示。请根据题意回答问题:
已知:Al(OH) 3+NaOH═NaAlO 2+2H 2O
(1)B点溶液中所含溶质是 (填化学式)。
(2)求图中A点的坐标: 。
(3)原混合溶液中MgCl 2的质量分数是多少?(写出计算过程,计算结果精确到0.1%)

试题篮
()