工业上利用高温分解石灰石(主要成分CaCO3,杂质不参与任何反应),得到生石灰。现实验室利用此原理来分析石灰石的纯度,使用100g原料,完全分解后得到固体64.8g,计算:
(写出计算过程)
(11)反应中得到的二氧化碳气体的物质的量为多少摩尔?
(12)原料中的碳酸钙纯度为多少?
某化工厂排放的废水中含有一定量的氢氧化钾,为了回收利用,欲用2%的稀盐酸测定废水中的氢氧化钾含量(废水中其他杂质不与盐酸反应),现取50g废水于锥形瓶中,逐滴加入2%的稀盐酸至恰好完全反应时,消耗稀盐酸7.3g,求废水中氢氧化钾的质量分数。
某同学用取氯酸钾和二氧化锰的混合物20g,加热制取氧气,待完全反应并冷却后称量,得到15.2g固体物质,试计算:
(1)反应中产生氧气的质量为 ;
(2)原混合物中二氧化锰的质量.(写出计算过程)
在氯化钙和氯化钠的混合物中加入一定量的水,全部溶解得到50克混合溶液,向该溶液中逐滴加入一定溶质质量分数的碳酸钠溶液,生成沉淀与加入碳酸钠溶液的质量关系如图所示.计算:
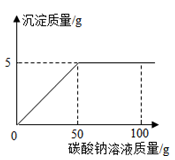
(1)所加碳酸钠溶液的溶质质量分数.
(2)若恰好完全反应时所得溶液的溶质质量分数为10%,则原固体混合物的质量是多少?
在实验室里加热30g氯酸钾(KClO3)和二氧化锰的混合物制取氧气,完全反应后剩余固体的质量为20.4g。请计算:
(1)生成氧气的质量为_________;
(2)原混合物中氯酸钾的质量。
碳和氧化铜反应生成铜和二氧化碳.现有碳和氧化铜的混合物20g.其中氧元素的质量分数为18%,高温加热该混合物一段时间后,产生4.4g二氧化碳。计算:
(1)参加反应的氧化铜的质量。
(2)剩余固体中氧元素的质量分数(计算结果保留到0.1%)。
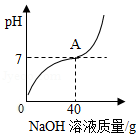
某工厂化验室用10%的氢氧化钠溶液洗涤一定量石油产品中的残余硫酸(该产品中其它物质不与NaOH反应),消耗氢氧化钠溶液的质量与反应过程中溶液的pH值关系如图所示。
(1)图中A点表示的意义是 。
(2)A点消耗氢氧化钠溶液的溶质的质量为 g。
(3)求石油产品中残余硫酸的质量(写出计算过程)。
铝合金的生产与销售是潍坊市一条重要的产业链,为测定某种铝铜合金中铝的质量分数,探究小组进行了如下实验:
| 实验编号 |
铝铜合金的质量(g) |
加入稀硫酸的质量(g) |
生成H2的质量(g) |
| 实验1 |
30 |
392 |
2 |
| 实验2 |
30 |
588 |
3 |
| 实验3 |
30 |
600 |
3 |
(1)所用稀硫酸溶质的质量分数为.
(2)该铝铜合金中铝的质量分数是多少?
某氯化钠溶液中含有氯化镁(MgCl2),学习小组为测定其中氯化镁的质量分数,在50.0g该溶液中加入50.0g氢氧化钠溶液恰好完全反应,经测定生成沉淀的质量为2.9g。请回答下列问题:
(1)反应后溶液的质量为 g;
(2)求原氯化钠溶液中氯化镁的质量分数(写出计算过程)。
某工厂化验室用20%的氢氧化钠溶液洗涤一定量石油产品中的残余硫酸,共消耗氢氧化钠溶液20g,洗涤后的溶液呈中性。这一定量石油产品中含H2SO4的质量是多少?(写出计算过程)
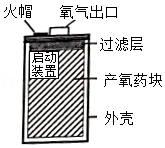
某简易制氧装置的示意图如图,其原理是通过撞击火帽触发启动装置产生热量,使产氧药块分解而持续释放氧气。
(1)装置中过滤层的作用是 。
(2)若产氧药块由氯酸钾(KClO3)和二氧化锰等组成,为得到一个人呼吸2小时所需氧气的量(折算后质量为48g),计算产氧药块中至少含氯酸钾的质量(写出计算过程)。
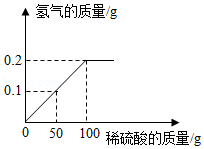
铜锌合金又称假黄金。向盛有30g铜锌合金粉末样品的烧杯中逐渐加入稀硫酸,生成氢气的质量与加入稀硫酸的质量关系如图所示,计算:
(1)充分反应后生成氢气的质量为 g。
(2)合金样品中锌的质量。
(3)恰好完全反应时,所得溶液溶质的质量分数。(结果保留一位小数)
科学兴趣小组同学在综合实践活动中了解到,某石灰厂有一批石灰石原料,其中含有的杂质二氧化硅(二氧化硅不溶于水,不能与盐酸反应,高温时不发生分解反应).为了测定该石灰石的纯度,兴趣小组同学取用2克这种石灰石样品,用实验室现有的未知溶质质量分数的稀盐酸20克分4次加入,充分反应后,经过滤、干燥等操作后称量,每次盐酸用量及剩余固体的质量见表,利用实验数据绘制的图象见图.
| 稀盐酸的用量 |
剩余固体的质量 |
| 第一次加入5克 |
1.5克 |
| 第二次加入5克 |
克 |
| 第三次加入5克 |
0.5克 |
| 第四次加入5克 |
0.3克 |
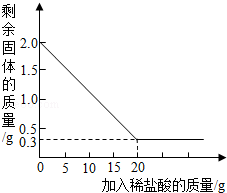
计算:
(1)分析上述图与表,第二次加入稀盐酸后,剩余固体的质量是 克;
(2)该石灰石样品中碳酸钙的质量分数;
(3)所用稀盐酸中溶质的质量分数是多少?
试题篮
()