金属在生产和生活中有广泛的应用。
(1)铁在潮湿的空气中易生锈的原因是 。
(2)向硝酸银溶液中加入一定量的锌和铜的混合粉末,充分反应后过滤,滤液呈蓝色,则滤出的固体中一定含有 ;滤液中一定含有的金属离子是 (写离子符号)。
(3)某同学称取黄铜(铜锌合金)样品20g放入锥形瓶中,向其中加入100g稀硫酸恰好完全反应,测得反应后剩余物的质量为119.8g,则所用稀硫酸中溶质的质量分数为 。
下列实验用品常用于实验室制取气体,回答下列问题:
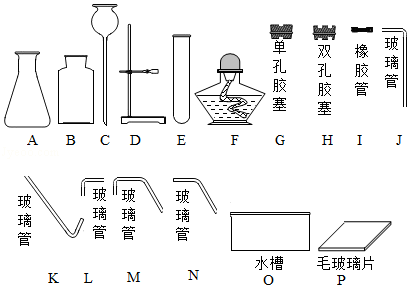
(1)仪器E的名称是 ;
(2)用2KMnO4 K2MnO4+MnO2+O2↑来制取O2,并用排水法收集,组装制取装置时,除选用图中的B、D、E、G、I、K、N、P外,还必须选用图中的 ;
(3)按上述反应加热31.6g的KMnO4完全反应后,理论上剩余固体质量为 g。
今后学习常见物质时,会从“价”和“类”两个方面进行学习。如图表示铁元素的常见化合价与含铁物质类别的关系。
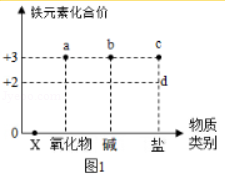
(1)X的物质类别是 。
(2)铁和稀硫酸反应生成的含铁化合物属于如图1中的 (填序号)。
(3)某同学想用物质a制取物质b,设计了如图2实验步骤:
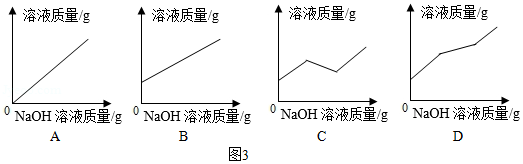
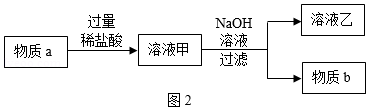 物质a与稀盐酸反应的化学反应方程式为 。溶液乙中的溶质一定有 。如果向盛有溶液甲的烧杯中滴加NaOH溶液至过量,图3中图象能正确表示烧杯中溶液质量变化的是 (填序号)。
物质a与稀盐酸反应的化学反应方程式为 。溶液乙中的溶质一定有 。如果向盛有溶液甲的烧杯中滴加NaOH溶液至过量,图3中图象能正确表示烧杯中溶液质量变化的是 (填序号)。
中国古代四大发明之一的"黑火药"是由木炭(C)、硫粉(S)和硝酸钾(KNO 3)按一定比例混合而成。
(1)分类。下列关于"黑火药"说法正确的是 。
a."黑火药"由"黑火药分子"构成
b."黑火药"中的KNO 3属于复合肥料
c."黑火药"中的C、S不再保持各自的化学性质
(2)变化。"黑火药"爆炸时发生的主要反应是:S+2KNO 3+3C═K 2S+N 2↑+3 ↑。
①依据质量守恒定律,空格上缺少的物质是 (填化学式)。
②"黑火药"爆炸时能闻到刺鼻的火药味,是因为爆炸时除了有硫化物,还有硫的氧化物生成。硫在空气中燃烧的化学方程式为 。
(3)制备。古代曾用硝土(含有Ca(NO 3) 2、少量NaCl等)和草木灰(含有K 2CO 3)作原料制取KNO 3.某化学兴趣小组设计了如图实验流程:
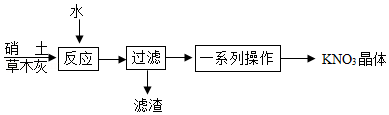
①"反应"过程中的化学方程式为 。
②"过滤"操作必须用到的玻璃仪器有烧杯、玻璃棒和 。
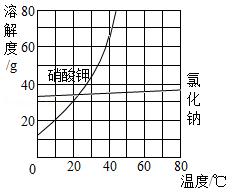
③如图是硝酸钾和氯化钠的溶解度曲线。"一系列操作"包括"加热蒸发浓缩、再冷却到一定温度、过滤"等步骤。其中"冷却到一定温度"能获得纯度较高的硝酸钾晶体的原因是 。
(4)发展。现代国防、开矿等使用的烈性炸药,主要成分为硝化甘油(C 3H 5O 9N 3)。
①硝化甘油在人体内能缓慢氧化生成一种氮的氧化物,用于治疗心绞痛。该氧化物中氮为+2价,其化学式为 。
合成硝化甘油的化学方程式为C 3H 8O 3+3HNO 3═C 3H 5O 9N 3+3H 2O.现用46kg甘油(C 3H 8O 3)和足量硝酸反应,理论上能生成多少硝化甘油?(写出计算过程)
氧气是人类无法离开的物质。
(1)工业上常采用分离液态空气的方法获取O2.能说明空气中存在氧气的事例有 (写一点即可)。
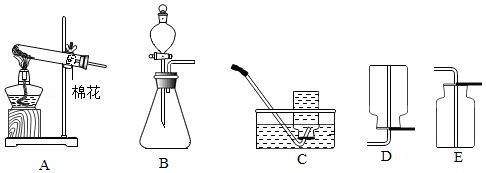
(2)实验室用双氧水和二氧化锰制取并收集氧气,可选择的装置组合是 。
(3)高锰酸钾制取O2时,常用 (填仪器名称)提供热源;现制取3瓶氧气,集气瓶容积为250mL,需要高锰酸钾的质量至少为 g(通常氧气的密度约为1.34g/L,结果精确到0.1g)。
(4)某些空气净化剂含超氧化钾,其净化原理为:4KO2+2CO2═2K2CO3+3O2.该方法一般不用于实验室制取氧气的原因是 (写一点即可)。
一种制备氢氧化镁的生产流程如图所示,MgCl 2和NaOH按恰好完全反应的比例加料。
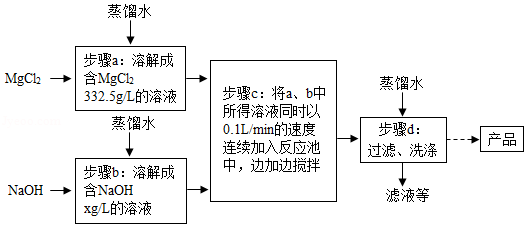
(1)写出步骤c中发生反应的化学方程式: 。
(2)x= 。
(3)过滤得到的粗产品还要经过洗涤,洗涤时主要除去的杂质是 。
(4)如图流程中若用下列物质代替氢氧化钠,也能制得氢氧化镁的是 。
①盐酸 ②氯化钙 ③氨水 ④硫酸镁
为了测定某纯碱样品中Na 2CO 3的质量分数。某化学兴趣小组的同学称取该纯碱样品11.0g,加入到足量的稀盐酸的烧杯中,充分反应后,称取烧杯内物质的总质量,发现比反应前物质的总质量减少了4.4g(纯碱样品中杂质不溶于水,不与酸反应)。求该纯碱样品中Na 2CO 3的质量分数(精确到0.1%)。
73g盐酸与足量锌粒反应,生成的气体在标准状况下的体积为4.48L.(在标准状况下,氢气的密度为0.0899g/L)
(1)生成的气体的质量为 (结果保留1位小数)。
(2)计算盐酸中溶质的质量分数(写出计算过程)。
乙醇俗称酒精,可以用作酒精灯、内燃机等的燃料,用灯帽盖灭酒精灯的灭火原理是 ;乙醇完全燃烧的化学方程式为 ;现有乙醇和乙醛(CH3CHO)的混合物共13.4g,完全燃烧后生成26.4g CO2,则生成水的质量为 g。
CO2的捕集与资源化利用是化学研究的热点。
(1)控制CO2的排放,是为了减缓 效应,加压水洗法可捕集CO2,是因为压强增大时CO2在水中的溶解度 (填“增大”“不变”或“减小”)。
(2)石灰石循环法可用于捕集烟气中的CO2,该方法以CaO捕集CO2,将所得产物在高温下煅烧可重新获得CaO,高温煅烧时反应的化学方程式为 ,生成的CaO疏松多孔,结构与活性炭相似,其在捕集过程中对CO2具有良好的 性。
(3)对CO2气体加压、降温,可获得干冰。从构成物质的微粒视角分析,该过程主要改变的是 。干冰能用于人工降雨,是因为 。
(4)CO2可用于食品保鲜,实验测得气体中CO2的体积分数与溶液pH的关系如图1所示。
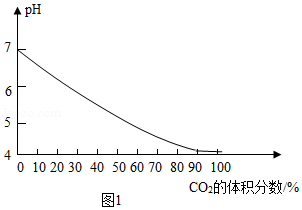
①气体中CO2体积分数增大时,造成图示变化的主要原因是溶液中 浓度增大(填化学式)。
②智能化食品包装通过颜色变化显示包装内CO2气体含量的变化,举出一种可通过颜色变化用于该智能化包装的物质 。
(5)已知一定条件下CO2与H2以质量比11:2反应可生成CH4.与该反应类似,不同条件下,CO2与H2反应也能生成甲醇(CH4O)。生成甲醇时参加反应的CO2与H2的质量比 。
(6)为研究某公园中植物与大气间的碳交换,对该公园一年内每天的气温及光合有效辐射进行测量,结果见图2和图3.通过测量其一年内每天空气中CO2含量等数据,分析所得碳交换的结果见图4.碳交换以每月每平方米植物吸收或释放CO2的质量表示,正值为净吸收CO2,负值为净释放CO2。

①由如图可推测,影响公园中植物与大气碳交换的因素有 。
②为进一步研究环境因素对公园中植物与大气碳交换的影响,从光合作用的角度出发,还需测量的重要因素是其一年内每天 的变化。
金属在生产、生活和社会发展中应用较为广泛,中国制造,让世界瞩目!
(1)航天:我国用长征三号乙运载火箭成功发射第55颗北斗导航卫星,化学材料在其中起到了重要作用,铝合金和钛合金被广泛用于航天工业、一般情况下,铝合金的强度和硬度比纯铝 (填“高”或“低”)。
(2)交通:制造港珠澳大桥需要大量的钢铁,请写出一种防止钢铁生锈的方法: 。
(3)冶炼:我国湿法炼铜很早就有记载,东汉《神农本草经》曾记载石胆“能化铁为铜”。向硝酸铜和硝酸银的混合溶液中加入一定量的镁粉,充分反应后过滤,滤液呈蓝色,则滤出的滤液中一定含有金属离子是 。
(4)应用:随州编钟被誉为“世界第八大奇迹”,代表了我国古代青铜工艺的较高水平,青铜是铜锌合金。现有铜锌合金质量20克,与100克质量分数为19.6%的稀硫酸恰好完全反应,则铜锌合金中铜的质量分数为 。
二氧化氯(ClO2)是安全消毒剂,杀菌能力优于Cl2,可由NaClO2与Cl2反应制得。
(1)配平化学方程式: NaClO2+ Cl2═ ClO2+ NaCl。
(2)71g Cl2完全反应,理论上最多生成ClO2的质量为 g。
实验室里,常采用加热高锰酸钾或分解过氧化氢的方法制氧气。
(1)高锰酸钾属于 (填"酸"、"碱"或"盐"),用它制氧气的化学方程式是 。
(2)高锰酸钾制氧气的实验中,不需要使用的一组仪器是 (填序号)。
a.烧杯 玻璃棒
b.大试管 集气瓶
c.酒精灯 铁架台
d.导管 单孔塞
(3)利用化学方程式计算,制取4.8g氧气,至少需要过氧化氢的质量是多少?
碳酸钠俗称纯碱或苏打,在生活、生产和实验研究中均有广泛应用。
[配制溶液]配制溶质质量分数分别为1%、2%和4%的Na2CO3溶液
(1)若配制50g溶质质量分数为4%的Na2CO3溶液,下列操作正确的是 (填字母)。
a.用托盘天平称取2g Na2CO3固体
b.选用50mL量筒量取所需体积的水
c.选用带玻璃塞的广口试剂瓶,将配好的溶液装瓶并贴标签
(2)分别测定25℃时,上述3种溶液的pH,记录数据如下:
实验编号 |
Ⅰ |
Ⅱ |
III |
溶质质量分数 |
1% |
2% |
4% |
溶液pH |
11.62 |
11.76 |
11.90 |
分析Ⅰ、Ⅱ、Ⅲ三组数据可得出的结论是 。
[制备物质]用Na2CO3溶液和FeSO4溶液发生复分解反应制备FeCO3
[已知溶液pH大于8.8时,Fe2+完全生成Fe(OH)2沉淀]
(3)在烧杯中制备FeCO3沉淀时,应选用的加料方式是 (填字母)。
a.将FeSO4溶液与Na2CO3溶液同时加入到烧杯中
b.将Na2CO3溶液缓慢加入到盛有FeSO4溶液的烧杯中
c.将FeSO4溶液缓慢加入到盛有Na2CO3溶液的烧杯中
(4)潮湿的FeCO3固体置于空气中易变质,反应如下:4FeCO3+6H2O+O2═4X+4CO2.则X的化学式为 。
[标定浓度]标定待测盐酸的溶质质量分数
(5)将Na2CO3固体在270℃干燥至恒重,准确称取0.212g无水Na2CO3于锥形瓶中,加入50mL蒸馏水溶解,滴入待测盐酸,当两者恰好完全反应时,消耗盐酸的体积为20.00mL(该盐酸的密度近似等于lg•mL﹣1,反应中Na2CO3所含的碳元素全部转化为CO2)。
①列式计算待测盐酸的溶质质量分数(结果用百分数表示,保留两位小数)。
②若上述测定过程中Na2CO3固体未经充分干燥,则测出盐酸的溶质质量分数将 (填“偏大”、“偏小”或“无影响”)。
化学与生产和生活密切相关。请回答下列问题:
(1)俗语道“酒香不怕巷子深”,原因是 (用微粒的观点解释)。
(2)武德合金常用作保险丝,是因为合金的熔点比组成它的纯金属的熔点要 (填“高”或“低”)
(3)“灯影牛肉”是达州的一张美食名片,其牛肉中主要含有的营养物质是 (填字母序号)。
A.糖类 B.蛋白质 C.油脂 D.维生素
(4)华为公司研发了一种以甲醇为原料的新型手机电池,其容量为锂电池的10倍,可连续使用1个月才充一次电,其电池反应原理为:2CH3OH+3X+4NaOH═2Na2CO3+6H2O.其中X的化学式为 。
(5)人们在使用含碳燃料过程要注意通风,如果氧气不足会产生一氧化碳,使人中毒。某液化石油气中含有丙烯,其化学式为C3H6.小王同学取4.2g丙烯和12.8g氧气在一密闭容器中点燃,恰好完全反应,测得生成二氧化碳的质量8.8g,一氧化碳的质量2.8g,那么生成水的质量 g,写出该反应的化学方程式 。
试题篮
()