氢氧化钴[Co(OH)2]受热易分解,能与酸性溶液反应,可作涂料和清漆的干燥剂,制备方法为:①Co+2HCl=CoCl2+H2↑,②CoCl2+2NaOH=Co(OH)2↓+2NaCl。下列判断正确的是
| A.钴的金属活动性比铜的弱 | B.①为置换反应,②为复分解反应 |
| C.氢氧化钴的化学性质稳定 | D.氢氧化钴可以干燥氯化氢气体 |
(1)下列关于氢氧化钡性质的描述中,不属于碱的共同性质的是 。
| A.能使紫色石蕊溶液变蓝色 | B.能与盐酸反应生成水 |
| C.能与Na2CO3溶液反应生成沉淀 | D.能与CO2反应生成水 |
(2)碱能表现出一些共同的性质,这是因为碱溶液中都含有 (用符号表示)。
(3)根据下图可以看出酸与碱发生中和反应的微观本质是 。
(4)请写出氢氧化钡与下列物质反应的化学方程式:
①与CO2反应 ;
②与Na2SO4溶液反应 。
下列选项符合图示从属关系的是
| |
X |
Y |
Z |
| A |
碱 |
酸 |
化合物 |
| B |
非金属单质 |
金属元素 |
元素 |
| C |
化合反应 |
氧化反应 |
化学反应 |
| D |
饱和溶液 |
不饱和溶液 |
浓溶液 |
粗盐中含有难溶性杂质(泥沙)和多种可溶性杂质(氯化镁、氯化钙和硫酸钠等),某 班同学现要进行粗盐提纯实验,为除去粗盐中的泥沙、 CaCl2、MgCl2、Na2SO4得到纯净NaCl,可将粗盐溶解于水,然后进行下列五项操作:①过滤②加适量盐酸③加过量Na2CO3溶液④加过量NaOH溶液⑤加过量BaCl2溶液⑥蒸发,请回答下列问题:
(1)以上提纯过程中,正确的操作顺序是 (写一组即可)。
(2)请写出实验中加入过量NaOH溶液时发生的化学反应方程式
(3)此过程中加入Na2CO3溶液的目的是
(4)请写出加入适量盐酸时发生的化学反应方程式 (写一个即可)。
(5)蒸发过程中,用玻璃棒搅拌的目的是
(6)现用所得精盐固体配制50g质量分数为6%的NaCl溶液,需NaCl g,配制此溶液的实验步骤为:计算、 、 、装瓶贴签。
(7)下列情况会造成所配制溶液的溶质质量分数偏小的是( )
A.得到的NaCl未完全干燥
B.用量筒量取水时,仰视读数
C.配好的溶液装瓶后,烧杯内有溶液残留.
A是一种黑色难溶于水的氧化物。请分析如下转化关系并填空。
(1)用化学式表示:A C
溶液B中的溶质是 溶液D中的溶质是
(2)用化学方程式表示:① A + 硫酸 ② 蓝色溶液B + 铁粉
等质量的X、Y两种金属分别和足量的同体积、同浓度的盐酸反应,产生气体的质量与时间的关系如图所示.下列说法中不正确的是
| A.t1时,产生气体的质量:X>Y |
| B.t2时,消耗金属的质量:X>Y |
| C.t3时,消耗金属的质量:X=Y |
| D.t3时,消耗盐酸的质量:X=Y |
小亮在实验室发现一瓶盛有无色溶液的试剂瓶,其标签破损,从残余部分只能看出溶质质量分数为10%,具体是什么物质无法辨认。老师告诉他,这瓶溶液可能是氢氧化钠、氯化钠、氢氧化钙或是碳酸钠中的一种。
(1)小亮查阅氢氧化钙常温下的溶解度为0.18g后,认为该溶液不可能是氢氧化钙,理由是 。
(2)小亮用洁净干燥的玻璃棒蘸取该溶液滴到湿润的pH试纸上,测得pH=10,他判断该溶液中不可能是氯化钠。对他的操作方法、测量结果及结论的评价,正确的是 ;
| A.方法正确,结果正确,且结论正确 |
| B.方法不正确,结果偏小,但结论正确 |
| C.方法不正确,结果偏大,结论不正确 |
| D.方法正确,结果正确,但结论不正确 |
(3)为了进一步确定该溶液的成分,小亮继续进行下列实验。
[设计实验方案]方案甲:选择氯化钡溶液来确定该溶液的成份;
方案乙:选择稀硫酸来确定该溶液的成份。
[进行实验]在两个方案中选一个方案,填写步骤、现象、结论。
| 实验步骤 |
实验现象 |
实验结论 |
| 取少量溶液于试管,加 。 |
|
该溶液是碳酸钠溶液。有关反应的化学方 程式为 |
[实验反思]
①有同学认为还可以用一种常见的碱溶液来确定是碳酸钠,那么它是 溶液。有关反应的化学方程式为:
_ _________________ 。
(4)用“侯氏制碱法”制得的纯碱中常含有少量的氯化钠。为测定某纯碱样品中碳酸钠的质量分数,小明设计如下方探究方案:取纯碱样品11g,加足量氯化钙溶液,充分反应后过滤,洗涤,称量,得到10g白色滤渣。求该纯碱样品中碳酸钠的质量分数。(精确到0.1%)
(5)探究方案中因缺少 _ (填操作名称),导致碳酸钠的质量分数偏大。
碳酸钡(化学式为BaCO3)广泛应用于显像管、陶瓷、光学玻璃等行业。有一种碳酸盐矿石其主要成分为碳酸钡和碳酸钙,以此矿石为原料生产碳酸钡的流程如下图所示。
【已知】:1、碳酸钡和碳酸钙具有相似的化学性质,高温下能分解成两种氧化物;氧化钡和氧化钙都能与水反应生成对应的碱,这两种碱均可以和二氧化碳反应。
2、下表所示的是两种碱在不同温度下的溶解度。
| 温度/℃ |
0 |
40 |
80 |
| Ca(OH)2溶解度/g |
0.187 |
0.141 |
0.094 |
| Ba(OH)2溶解度/g |
1.67 |
8.22 |
101.4 |
(1)写出水浸池中氧化钙与水反应的化学方程式: 。
(2)以下相关说法错误的是
A.焙烤炉中添加焦炭粉和热空气是为了维持炉内反应所需的高温状态
B.焙烤炉内只涉及分解反应
C.废渣需要经过洗涤才能弃渣,是为了保护环境,同时为了提高产率
D.该工艺流程可以减少CO2气体的排放,控制温室效应
(3)除了水之外,进入分离池中的物质是 ,请你根据所给两种碱的溶解度推测分离池中操作②的步骤是 (选填“降温”、“加热”)、过滤。
(4)写出由溶液B制取产品碳酸钡的化学方程式: 。
【问题情景】某化学实验小组的同学将铁粉投入硫酸铜溶液中,发现生成红色固体物质的同时有较多气泡放出。这一现象激发起同学们的探究欲望:生成了什么气体?
【提出猜想】从物质组成元素的角度,放出的气体可能是SO2、O2、H2。
【查阅资料】SO2易溶于水,它能与NaOH溶液反应,生成Na2SO3。
【方案设计】依据上述猜想,实验小组同学分别设计了如下方案:
(1)甲同学认为是O2,则检验方法是 。
(2)乙同学认为是SO2,则只需将放出的气体通入盛有NaOH溶液的洗气瓶中,称量通气前后洗气瓶的质量。写出SO2与NaOH溶液反应的化学方程式 。
(3)实验小组同学合作设计了如图组合实验方案,排除和验证猜想的气体。
如果放出的是O2和H2,你认为方案中的安全隐患是 ,丙同学认为:为确保安全,实验前应先收集一试管气体,然后 ,若听到 ,方可采用上面的装置进行实验;如果听到 ,则不能采用上述装置。
【实验探究】经丙同学确认安全后,小组同学首先对装置A进行称量,再将收集到的气体从a通入,过一会儿点燃B处酒精灯;一段时间后,发现表面含CuO的铜网由黑色变为光亮的红色;停止通气,再次称量装置A,发现质量无增减。
(4)结论:铁粉与硫酸铜溶液反应时,产生的气体是 。
(5)由上述实验可以推出,硫酸铜溶液中可能含有 。(填物质化学式)
(6)不通过称量,如何判断SO2与NaOH溶液发生了反应呢?有一同学设计了下图所示的装置进行实验,发现试管内液面上升,就得出SO2与NaOH溶液发生反应的结论。其他同学认为这一方案不严谨,理由是 。要得到科学严谨的结论,仍利用该装置,需要补做的实验是 。
下列图像不能正确反映其对应关系的是
| A.加热一定质量的高锰酸钾 |
| B.向盐酸和氯化钙的混合溶液中不断滴加碳酸钠溶液 |
| C.向等质量等质量分数的稀盐酸中分别加入过量的锌和铁 |
| D.浓硫酸敞口放在空气中 |
阅读下面科普短文。
肼(N2H4)又称联氨,有类似于氨的刺鼻气味,贮存时用氮气保护并密封,用途广泛。肼燃烧放热量大且燃烧产物对环境无污染,常用作火箭燃料,点燃时与助燃物质液态N2O4发生反应,生成N2和H2O。高压锅炉水处理时用于脱除氧气以防止锅炉的腐蚀,也可以把锅炉内表面锈蚀后的氧化铁还原为结构紧密的四氧化三铁保护层,减缓锅炉锈蚀。用于烟草、土豆、玉米的贮藏,用于食用盐酸的制造等。熔点1.4℃,沸点113.5℃;有强烈的吸水性,形成水合肼(N2H4·H2O),可以用固体烧碱进行脱水;能吸收空气中的二氧化碳;易溶于水;与液氧接触能自燃;长期暴露在空气中或短时间受热时易发生分解。对眼睛有刺激作用,能引起延迟性发炎,对皮肤和粘膜也有强烈的腐蚀作用。
依据短文内容,回答下列问题:
(1)肼的下列性质中,属于化学性质的是 (填字母序号,下同)。
A.与氧化铁作用 B.易溶于水
C.易分解 D.有刺鼻的气味
(2)肼在常温下为______(填“固态”“液态”或“气态”)。
(3)肼作为火箭燃料燃烧时反应的化学方程式为 。
(4)肼有强烈的吸水性,能吸收空气中的CO2,下列物质中的 也具有这些性质。
A.NaCl B.Ca(OH)2 C.NaOH D.NaHCO3
(5)肼需要密封保存的原因是______。
欲探究久置的生石灰粉末样品的变质情况,下列分析和结论错误的是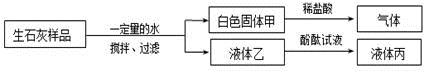
| A.液体丙呈红色或无色 |
| B.该样品中一定含有碳酸钙 |
| C.若液体丙呈无色,说明该样品已部分变质 |
| D.白色固体甲可能为Ca(OH)2和CaCO3的混合物 |
老师在装有酸的储物柜中发现一瓶没有标签的溶液,让同学们鉴定该溶液是否为盐酸溶液。
| 实验步骤 |
实验现象 |
实验结论 |
| 1.取少量待测液体与试管中,滴加几滴石蕊溶液 |
|
溶液呈酸性 |
| 2.取少量待测液与试管中,滴加 溶液 |
产生了白色沉淀 |
该待测溶液为盐酸 |
| 3.往上述2中的沉淀滴加 溶液 |
|
写出上述操作2中所发生的化学方程式: 。
试题篮
()