下列不能正确反映相关实验过程中量的变化关系的图象是()
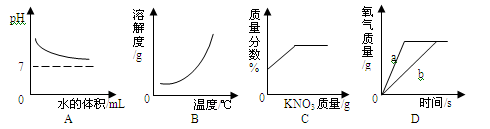
| A. | 氢氧化钠溶液加水稀释 |
| B. | 一定压强下,氧气在水中的溶解度 |
| C. | 一定温度下,向不饱和硝酸钾溶液中加入硝酸钾 |
| D. | 氯酸钾和二氧化锰混合加热制氧气中,a使用催化剂,b未使用催化剂 |
(7分) 据报道,一辆载满20t电石的货车,在高速路上发生意外,燃起大火并伴有大量黑烟,这辆货车在雨中燃烧了很长时间。某化学小组对电石中碳化钙(CaC2)的性质产生了兴趣,进行了下列探究活动。
【查阅资料】①碳化钙与水反应生成一种可燃性气体和一种白色固体。
②乙炔(C2H2)气体燃烧时伴有大量黑烟。
【猜想假设】甲同学对碳化钙与水反应的生成物作出如下猜想:
可燃性气体可能是:①氢气 ②氧气 ③乙炔
白色固体可能是: ①氧化钙 ②氢氧化钙 ③碳酸钙
(1)你认为甲同学猜想的理由是 。
(2)其他同学讨论后认为甲同学的猜想有不合理之处,请指出并说明理由
。
【实验探究】
步骤1:取适量碳化钙加水,收集生成的气体,验纯后点燃,气体燃烧,伴有大量黑烟,说明碳化钙与水反应产生的气体是 。
步骤2:取适量反应后生成的固体于试管中, ,说明碳化钙与水反应产生的固体是氢氧化钙。
【反思交流】
(1)碳化钙与水反应的化学方程式为 。
(2)下列说法正确的是 (填字母序号)。
| A.碳化钙与水反应放热 |
| B.碳化钙应贮存在阴凉干燥的库房 |
| C.碳化钙与水反应可用于测定电石中碳化钙的含量 |
| D.实验室用电石与水制乙炔的发生装置与制氧气完全相同 |
下列各组溶液混合,能发生化学反应,并且一定能得到无色透明溶液的是( )
| A. | , , | B. | , , |
| C. | , , | D. | , , |
下列图像与对应选项关系合理的是
| A.在某温度下,向一定量接近饱和的硝酸钾溶液中,不断加入硝酸钾晶体 |
| B.向NaOH溶液中滴中稀盐酸至过量 |
| C.用相等质量的氯酸钾来制取氧气 |
| D.电解水生成氢气和氧气 |
【问题情景】某化学实验小组的同学将铁粉投入硫酸铜溶液中,发现生成红色固体物质的同时有较多气泡放出。这一现象激发起同学们的探究欲望:生成了什么气体?
【提出猜想】从物质组成元素的角度,放出的气体可能是SO2、O2、H2。
【查阅资料】SO2易溶于水,它能与NaOH溶液反应,生成Na2SO3。
【方案设计】依据上述猜想,实验小组同学分别设计了如下方案:
(1)甲同学认为是O2,则检验方法是 。
(2)乙同学认为是SO2,则只需将放出的气体通入盛有NaOH溶液的洗气瓶中,称量通气前后洗气瓶的质量。写出SO2与NaOH溶液反应的化学方程式 。
(3)实验小组同学合作设计了如图组合实验方案,排除和验证猜想的气体。
如果放出的是O2和H2,你认为方案中的安全隐患是 ,丙同学认为:为确保安全,实验前应先收集一试管气体,然后 ,若听到 ,方可采用上面的装置进行实验;如果听到 ,则不能采用上述装置。
【实验探究】经丙同学确认安全后,小组同学首先对装置A进行称量,再将收集到的气体从a通入,过一会儿点燃B处酒精灯;一段时间后,发现表面含CuO的铜网由黑色变为光亮的红色;停止通气,再次称量装置A,发现质量无增减。
(4)结论:铁粉与硫酸铜溶液反应时,产生的气体是 。
(5)由上述实验可以推出,硫酸铜溶液中可能含有 。(填物质化学式)
(6)不通过称量,如何判断SO2与NaOH溶液发生了反应呢?有一同学设计了下图所示的装置进行实验,发现试管内液面上升,就得出SO2与NaOH溶液发生反应的结论。其他同学认为这一方案不严谨,理由是 。要得到科学严谨的结论,仍利用该装置,需要补做的实验是 。
下列图像能正确反映所对应叙述关系的是
| A.向氢氧化钠溶液中不断加水 |
| B.向不饱和的硝酸钾溶液中加入硝酸钾固体 |
| C.向H2S04和CuS04混合液中滴加NaOH溶液 |
| D.煅烧一定质量的石灰石 |
有人用经过粉碎的含有较多有机物杂质的粗铜,通过下列步骤制取硫酸铜晶体
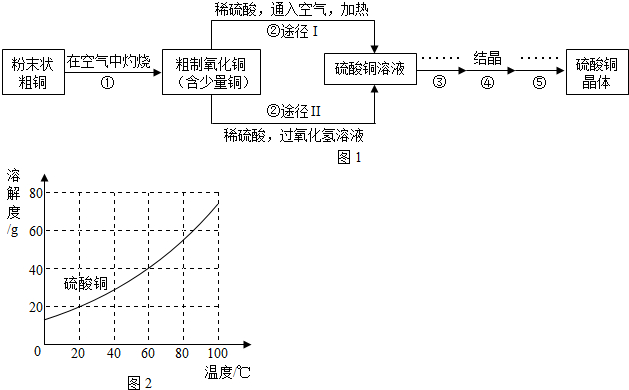
(1)若步骤①中灼烧温度过高会产生副产物氧化亚铜(铜的化合价为+1价),其化学式为。
(2)写出步骤②中氧化铜与稀硫酸反应的化学方程式:。
(3)步骤②中,铜和稀硫酸不能直接发生置换反应的原因是。
(4)反应途径Ⅰ和Ⅱ,分别发生如下反应:
途径Ⅰ:
途径Ⅱ:
请选择你认为更适合于实际应用的途径,并说明理 由:。
(5) 根据图2,步骤④的结晶方法为。
(6)若800
粗制氧化铜(其中单质铜的质量分数为4%),通过途径Ⅱ转化为硫酸铜,计算参加反映的过氧化氢的质量。写出计算过程。
重结晶后的食盐中往往还含有少量的硫酸钠、氯化镁、氯化钙等杂质,它们在溶液中主要以SO2﹣4、Ca2+、Mg2+的形式存在,为将这些杂质除净,可向食盐溶液中加入过量的氢氧化钠、碳酸钠、氯化钡溶液,然后加入盐酸调至溶液pH=7,最后经过过滤、蒸发得到精盐.下列操作及加入溶液顺序错误的是( )
| A.BaCl2、NaOH、Na2CO3、过滤、HCl |
| B.BaCl2、Na2CO3、NaOH、过滤、HCl |
| C.NaOH、BaCl2、Na2CO3、过滤、HCl |
| D.Na2CO3、BaCl2、NaOH、过滤、HCl |
用盐酸可以清除铁锈(主要成分为Fe203),盐酸中主要含有H20分子、H+、c1﹣.某探究小组为探究稀盐酸中的哪种微粒能使氧化铁溶解,设计了如下实验方案,得出了初步结论.
(1)请填写下表中的实验结论:
| 实验过程 |
实验现象 |
实验结论 |
| 向盛有少量Fe2O3的试管中加入NaCl溶液振荡 |
固体不溶解 |
|
(2)是否需要做“向Fe2O3,中加入水”的对比实验?为什么?
为提高实验探究能力,某化学兴趣小组的同学在老师的指导下,对一瓶久置出现变质硬化的氢氧化钙固体进行如下探究活动。
【探究活动一】检验硬化的氢氧化钙样品是否完全变质
(1)用化学方程式表示氢氧化钙变质的原因:__ _。
(2)检验氢氧化钙样品是否完全变质,进行如下实验:
| 实验步骤 |
实验现象 |
实验结论 |
| 取氢氧化钙样品少量,研细后加适量蒸馏水充分混合后静置, __ __ |
__ __ |
该样品还含有氢氧化钙 |
【探究活动二】测定样品中含有的变质固体(以下用R表示)的质量分数
取3克部分变质的氢氧化钙样品与足量的稀盐酸反应,测量生成气体的体积(气体不溶于植物油),从而计算出样品中R的质量,便可求出样品中R的质量分数。实验装置(气密性良好)如图1所示。
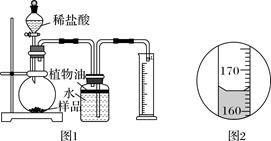
(3)将稀盐酸滴入样品中,产生气体的化学方程式为__ __,反应一段时间后,当观察到__ __(填实验现象),才停止滴加稀盐酸。
(4)实验中量筒的作用是_ _ _。
(5)实验结束后,量筒内进入水的体积如图2所示,其读数为__ __mL。已知在该实验条件下,生成气体的密度为2g·L-1,通过计算,样品中R的质量分数为__ _。
(6)上述图1所示实验装置和相关试剂,用来实验测定样品中R的质量分数是比较粗略的,请简要说明测定数据存在误差的原因:_ _(写一个)。
如图所示,在粗玻璃管内壁上粘附湿润的石蕊试纸,向细玻璃管里滴入数滴浓醋酸后,立即封闭管口.10s后即观察到:仅有中下部的石蕊试纸从上往下逐渐变色.
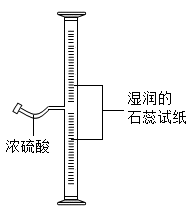
(1)本实验应选用 (填“红”或“蓝”)色石蕊试纸;
(2)本实验利用的醋酸性质包括:①酸性、② 性、③醋酸蒸气密度 (填“<”或“>”)空气密度;
(3)由实验现象可推知微粒具有的特征是 ;
(4)本实验用试剂Y代替浓醋酸也出现相似的现象,Y为 (填序号).
A.浓氨水 B.浓硫酸 C.浓盐酸.
由于二氧化碳与氢氧化钠反应无明显现象,对此同学们展开了探究,请你参与.
【提出问题】二氧化碳与氢氧化钠能否发生反应?
【查阅资料】常温下,氢氧化钠、碳酸钠在乙醇中的溶解性如下.
| 溶剂 |
乙醇 |
|
| 溶质 |
氢氧化钠 |
碳酸钠 |
| 溶解性 |
易溶 |
难溶 |
【方案设计】小明同学设计了如图所示装置进行探究。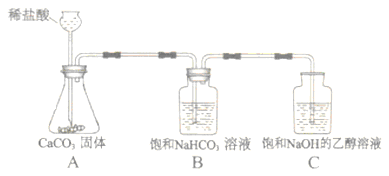
【实验探究】
(1)溶液配制.甲溶液:将一定质量的氢氧化钠固体加入到一定体积的乙醇中,用玻璃棒不断搅拌,使其成为饱和氢氧化钠的乙醇溶液.量取一定体积的乙醇要用到的仪器是,用玻璃棒搅拌的目的是。
乙溶液:将一定质量的氢氧化钠固体加入到一定体积的75%的乙醇溶液中,用玻璃棒不断搅拌,使其成为不饱和氢氧化钠的乙醇溶液.判断甲、乙溶液形成的现象是。
(2)进行实验,按图所示装置加入药品后进行实验.
中发生反应的化学方程式为,
装置的作用是,
中观察到的现象是。
【实验结论】
(3)由此小明得出二氧化碳与氢氧化钠发生了化学反应,反应的化学方程式为。
【反思交流】
(4)小刚同学认为小明的实验还足以证明二氧化碳与氢氧化钠发生了化学反应,还应补充的实验是。
(5)若将图
中甲溶液换成乙溶液进行实验,
中可能无明显现象发生,原因可能是。
下列选项符合图示从属关系的是
| |
X |
Y |
Z |
| A |
碱 |
酸 |
化合物 |
| B |
非金属单质 |
金属元素 |
元素 |
| C |
化合反应 |
氧化反应 |
化学反应 |
| D |
饱和溶液 |
不饱和溶液 |
浓溶液 |
除去下列物质中的少量杂质.所选用的试剂和操作方法都正确的是
| 选项 |
物质 |
杂质 |
试剂 |
操作方法 |
| A |
MnO2 |
KCl |
适量水 |
溶解、过滤、蒸发、结晶 |
| B |
CO2 |
H2 |
足量氧气 |
点燃 |
| C |
NaOH溶液 |
Ca(OH)2 |
适量Na2CO3溶液 |
过滤 |
| D |
稀盐酸 |
硝酸 |
适量硝酸银溶液 |
过滤 |
下图分别与相应的操作过程相对应,其中正确的是
| A.向一定量接近饱和的硝酸钾溶液中不断加入硝酸钾晶体(不考虑温度变化) |
| B.将镁片和锌片(均足量)分别和等质量、等溶质质量分数的稀硫酸混合 |
| C.向pH=10的氢氧化钙溶液中不断加水稀释 |
| D.向一定质量的硫酸铜溶液中加入过量的氢氧化钠溶液 |
试题篮
()