珍珠粉是由珍珠经加工制成的白色粉末,含有碳酸钙、蛋白质等成分,是重要的药品、化妆品原料.但市场上出现的假珍珠粉外观上与真珍珠粉差不多,肉眼往往无法辨别它们.
(1)为了寻找区分真假珍珠粉的方法,科学兴趣小组的同学进行了如图1实验:
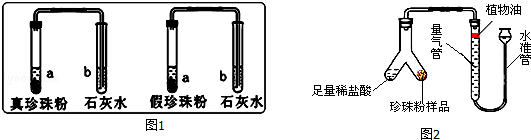
实验一:分别取真假珍珠粉适量置于两支试管中,加一定量的稀盐酸并将产生的气体通入澄清石灰水中,发现澄清石灰水均变浑浊,说明真假珍珠粉均含有 .
实验二:分别取真假珍珠粉稍许置于铁片上灼烧,发现真珍珠粉能闻到烧焦羽毛气味;假珍珠粉未闻到烧焦羽毛气味,由此可得出结论:假珍珠粉中不含 .
(2)为了比较真假珍珠粉中碳酸钙的含量,共进行了三次实验,每次各取5g真假珍珠粉,分别置于如图2实验装置中(稀盐酸足量且真假珍珠粉中只有碳酸钙与稀盐酸会反应生成气体),测定生成气体体积数据如下表:
| 样品气体体积mL次数 |
第一次 |
第二次 |
第三次 |
| 假珍珠粉 |
117.50 |
117.28 |
117.05 |
| 真珍珠粉 |
111.52 |
111.66 |
111.86 |
①量气管中水面上方加一层植物油的目的是 ,由实验数据可知:真珍珠粉中碳酸钙的含量 假珍珠粉(填“>”、“<”、“=”).
②根据三次测量结果,取平均值,算得5g真珍珠粉生成的气体质量为0.22g,求:真珍珠粉样品中CaCO3的质量分数.
如图是稀盐酸和氢氧化钠溶液,其中一种物质逐滴加入另一种物质过程中溶液酸碱度的变化情况.

(1)该实验操作是将 滴加到另一种溶液中.
(2)图中 点时溶液中酸和碱恰好完全反应.
(3)若要将36.5克10%的盐酸全部反应完,需要NaOH多少克?(HCl+NaOH═NaCl+H2O)
环保石头纸的主要成分为碳酸钙,加入适量聚乙烯和少量胶合剂。
【实验一】 探究影响石头纸与盐酸反应快慢的因素
(1)甲、乙两同学设计实验如下:
| |
甲 |
乙 |
| 实验过程 |
 |
 |
| 现象 |
试管①、②、③中产生气泡快慢的顺序为:①>②>③。 |
|
| 分析结论 |
Ⅰ 碳酸钙与稀盐酸反应的化学方程式为 ; Ⅱ 对比甲同学实验①②可知, ,化学反应的速度越快; Ⅲ 对比甲同学实验 (填实验序号)可知,反应物的接触面积越大,反应速率越 。 Ⅳ 乙同学的实验中,应该连续记录的实验数据是 和 。 |
【实验二】 测定石头纸中碳酸钙的质量分数 提示:石头纸中其他成分均不与盐酸反应,也不溶于水。
(2)甲组同学:图Ⅰ为石头纸与稀盐酸反应的装置,图Ⅱ用于测量通常状况下CO2的体积。

①实验前首先要 ;
② 图Ⅱ装置中油层的作用是 ;
③ 反应完成后,先 (填具体操作),然后才能准确读得量气管中的CO2的体积。
④根据V CO2和ρCO2计算出CO2的质量,计算碳酸钙质量。
(3)乙组同学:均匀称取四份样品分别和稀盐酸反应,用电子天平及有关装置,得出二氧化碳质量,实验数据记录如下表。
| |
第1份 |
第2份 |
第3份 |
第4份 |
| 取样品质量(g) |
6.25 |
6.25 |
6.25 |
6.25 |
| 取稀盐酸的体积(mL) |
10.0 |
20.0 |
30.0 |
40.0 |
| 产生气体的质量(g) |
0.88 |
1.76 |
2.20 |
m |
通过对数据的分析和比较,回答下列有关问题
①在第 份样品的实验中,样品中碳酸钙完全反应了; 。
② m的值为
③石头纸样品中碳酸钙的质量分数是多少?(请写出计算过程)
某品牌可乐由水、白砂糖、焦糖色素(使可乐显黑褐色)、磷酸(H3PO4)等,按一定比例混合并压入二氧化碳配制而成。某同学为了探究可乐的成分及其含量,进行如下实验。
实验一 可乐中二氧化碳的定性检验
(1)请完成下表:
| 实验步骤 |
实验现象 |
结论 |
| 打开一塑料瓶装可乐,塞上带导管的橡胶塞,把导管插入(填化学式)溶液中 |
观察到 | 可乐中含有二氧化碳 |
实验二 可乐中磷酸的定量测定
测定过程如下:

(2)步骤①用活性炭浸泡的目的是。
(3)步骤③煮沸10分钟的目的是除尽滤液中的。
(4)已知步骤④反应的化学方程式为
,测得共消耗0.1%的NaOH溶液20g,忽略可乐中其它成分对测定结果的影响,计算可乐中磷酸的含量(以g/L为单位。相对分子质量:
-98;
-40),写出计算过程。
(5)如果步骤②缺少洗涤,则测定结果(填"偏高""不变"或"偏低")。
兴趣小组的同学探究一瓶敞口放置的NaOH溶液(原质量分数为10%)是否变质,进行了下述实验:
| 同学 |
小柯 |
小江 |
小龙 |
| 操作 |
各取一支相同规格的试管,在试管中加入一定量的待测溶液 |
||
| 滴入无色酚酞 |
加入足量的 ? |
加入足量的BaCl2溶液 |
|
| 现象 |
变红 |
产生气泡 |
产生白色沉淀 |
| 结论 |
没变质 |
变质 |
变质 |
(1)小江加入的"?"是。
(2)小江认为小柯的实验和结论不正确,理由是。
(3)小龙将沉淀过滤、洗涤、干燥,称量质量为1.97
。已知小龙所取的待测溶液质量为10
,请根据化学方程式计算,该待测溶液中变质生成物的质量分数。
四氯化硅(
)是一种 重要的化工原料,遇水会发生如下反应:
某地曾发生将含有四氯化硅的废料倒入池塘造成污染的事件,事后环保人员在受污染的池塘中投放熟石灰〔
〕作了有效处理。
(1)已经
不跟
反应,为了确定投入熟石灰的质量,要先测定废料倒入池塘后生成盐酸的质量。选用下列哪组数据能确定池塘中生成
的质量
A.倒入废料的总质量、废料中
的质量分数
B.池塘水的
C.池塘水中
的质量分数
(2)经测定池塘水中共有0.365吨盐酸,则需要加入多少吨熟石灰才能将其完全反应。
(列式计算,相对原子质量:
:1
:16
:35.5
:40)
(7分)某校化学兴趣小组的同学开展了测定Na2CO3和NaCl的固体混合物中Na2CO3质量分数的探究实验。他们设计了如下的实验方案:
(1)“操作1”的名称是___________,溶液M中的溶质 (写化学式)。
(2)滴加CaCl2溶液应“过量”,否则可能会使测定的结果 (填“偏大”或“偏小”),确定CaCl2溶液是否过量的方法是 。
(3)该混合物中Na2CO3的质量分数是多少?(写出解题过程,计算结果精确到0.1%)
我国北方某盐湖生产的纯碱(Na2CO3)产品中常含有少量的氯化钠(其他杂质忽略不计),为测定该产品中碳酸钠的质量分数,现称取6g试样放在烧杯中并滴入稀盐酸,当盐酸滴加至36.5g时,烧杯内溶液的总质量为40.3g(假设产生的气体全部逸出),产生气体的质量与滴入稀盐酸的质量关系如图所示,试计算:
(1)A点产生气体的质量m= 。
(2)B点时,烧杯内溶液中的溶质是 (写出化学式)。
(3)试样中碳酸钠的质量分数(结果精确至0.1%)。
(10分)我国著名化学家侯德榜发明的“联合制碱法”主要原理是:I.向浓氨水中通入足量的CO2,使氨气、水和CO2发生化合反应而生成NH4HCO3溶液;II.向所得溶液中加入食盐细粒,充分搅拌,会析出溶解度较小的小苏打固体并得到化肥溶液;III.加热析出的固体制取纯碱。此法经过调整并应用于化工产业,某化工企业的工艺流程示意图如下:
请完成下列填空:
(1)“联合制碱原理II”中发生反应的化学方程式为 。
(2)在如图的流程中,先加Ca(OH)2溶液的目的是 ,再加入Na2CO3溶液的目的是 。
(3)“操作1”的名称是 ,“氨化溶液”后,溶液的pH 7(填:“大于”、“小于”或“等于”),从而有利于吸收“气体A”,气体A为 (填名称)。
(4)利用“270℃以上小苏打完全分解,纯碱受热不分解”的性质,化学兴趣小组的同学对实验室所购纯碱(假设所含杂质均为小苏打)进行了如下实验:称取20.00g干燥的固体样品放入坩埚,300℃恒温加热至质量不变,在干燥器中冷却后称量残留固体质量为19.38g。
根据题目所给信息,计算该样品中纯碱的质量分数(写出计算过程)。
现有一瓶久置的标有质量分数为10%的NaOH溶液样品,为探究其变质(NaOH易和空气中的CO2反应生成Na2CO3)的相关问题,利用U形管设计如下图所示的装置进行实验。
(1)如图甲所示,若此溶液变质,分别在U形管的两端滴入HCl溶液和澄清的石灰水时,观察到的现象:a端______ __ __,____ _______,b端___________________。
(2)如图乙所示,取此NaOH样品溶液20g放于U形管中,并在其中加入适量的酚酞试液,通过分液漏斗向U形管中滴入HCl溶液,当滴入20gHCl溶液时,恰好反应完全。
①滴入稀盐酸过程中,U形管中的溶液颜色变化为______________________________。
②恰好完全反应时,生产气体0.22g,试计算该溶液中Na2CO3的质量分数。
同学在帮助老师整理实验室时,发现了半瓶久置的氢氧化钙粉末,他们决定对这瓶氢氧化钙粉末的组成进行实验探究.
(1)提出问题:这瓶氢氧化钙是否已经变质?
(2)猜想与假设:该氢氧化钙粉末的成分为
I.氢氧化钙;
II.氢氧化钙、碳酸钙;
III._____①_________.
(3)设计方案、进行实验:请你参与探究,并填写下表
(4)联想与启示:氢氧化钙变质的原因___________⑤_________(用化学方程式表示),因此氢氧化钙应___⑥_____保存.
(5)【定量分析】为了进一步探究该氢氧化钙样品中各成分的质量,小组同学称取氢氧化钙样品12.4g于锥形瓶中,加入32.6g水,振荡形成悬浊液,向锥形瓶中逐滴滴加的稀盐酸,使其充分反应至无气体产生,测得加入盐酸的质量与锥形瓶中物质的质量关系如下表所示。
| 加入盐酸的质量/g |
0 |
25 |
37.5 |
| 锥形瓶中物质的质量/g |
45 |
70 |
80.3 |
(I)根据表中数据分析,加入盐酸的质量在0到25克时,仅有_⑦___与盐酸反应
(II)试求12.4g该样品中各成分的质量.
(13分)钠的化合物在日常生活中应用广泛.
(1)碳酸氢钠是发酵粉的成分之一,其俗称是 .
(2)氯化钠是重要的调味品,通过以下化学反应均能生成NaCl.
反应一:钠在氯气中燃烧.反应的化学方程式为 .
反应二:NaOH溶液与稀盐酸反应.关于该反应,下列说法正确的是
| A.该反应是中和反应 |
| B.将一定量的稀盐酸逐滴滴入NaOH溶液中,pH不断减小,说明两者发生了反应 |
| C.将一定量的稀盐酸滴入滴有酚酞的NaOH溶液中,溶液仍为红色,说明两者不反应 |
| D.将一定量的稀盐酸与NaOH溶液混合后溶液的pH=7,说明两者发生了反应 |
E.将NaOH固体放入稀盐酸中,放出热量,说明两者发生了反应
反应三:用Na2CO3溶液和稀盐酸混合.反应的化学方程式为: .
充分反应后的溶液中一定有NaCl,可能有Na2CO3或盐酸.
①为确定反应后溶液中的溶质,同学们进行了如下实验:
步骤I、确定溶液中是否含有盐酸:
甲同学选用了酸碱指示剂中的 试液;
乙同学选用了镁粉,通过实验观察到 ,确定溶液中一定没有盐酸.
步骤II、通过实验确定溶液中含有Na2CO3
②欲从反应后溶液中得到纯净的NaCl,丙同学设计了如下实验方案:
| 方案 |
加入试剂 |
分离方法 |
方案评价 |
| 一 |
适量Ba(OH)2溶液 |
过滤、蒸发结晶 |
不可行,理由是: |
| 二 |
适量的 |
|
可行 |
(3)(4分)过氧化钠(Na2O2)是供氧设备中常用的供氧剂.韩国“岁月号”沉船事故发生后,
几百名潜水员携带水下供氧设备参与了打捞工作.过氧化钠与水的反应为:2Na2O2+2H2O═4NaOH+O2↑.现将15.6g过氧化钠加入盛有147.6g水(过量)的烧杯中充分反应,直至固体完全消失,不再有气泡产生.
请计算:①反应生成的氧气质量;②反应后所得溶液中溶质的质量分数.(写出计算过程)
某同学取2.5g石灰石,滴加30g稀盐酸,所产生的气体质量与滴入盐酸质量的关系如下图所示。
试根据图中数据计算:
Ⅰ.反应生成二氧化碳的物质的量为 (19) mol.
Ⅱ.石灰石中碳酸钙的质量分数(根据化学方程式计算)。(20)
Ⅲ.该反应结束后,所得溶液中滴加石蕊试液,可观察到现象是 (21) 。
实验室有一瓶久置的氢氧化钠固体,某同学想了解其变质情况,设计了实验,实验过程如下:
实验一:取少量样品于试管中,滴加适量稀盐酸,观察到有气泡产生,说明氢氧化钠已变质,变质的原因是___________________________(用化学方程式表示)。
实验二:
通过实验二,能进一步推算出氢氧化钠变质的程度。请计算实验二中参加反应的碳酸钠质量。(化学方程式:Na2CO3+ CaC12=CaCO3↓+2NaCl)
结论:16.0 g干燥的样品中已变质的氢氧化钠的质量是 g。
试题篮
()