珍珠粉是由珍珠经加工制成的白色粉末,含有碳酸钙、蛋白质等成分,是重要的药品、化妆品原料.但市场上出现的假珍珠粉外观上与真珍珠粉差不多,肉眼往往无法辨别它们.
(1)为了寻找区分真假珍珠粉的方法,科学兴趣小组的同学进行了如图1实验:
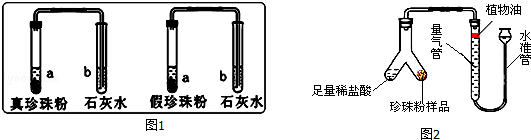
实验一:分别取真假珍珠粉适量置于两支试管中,加一定量的稀盐酸并将产生的气体通入澄清石灰水中,发现澄清石灰水均变浑浊,说明真假珍珠粉均含有 .
实验二:分别取真假珍珠粉稍许置于铁片上灼烧,发现真珍珠粉能闻到烧焦羽毛气味;假珍珠粉未闻到烧焦羽毛气味,由此可得出结论:假珍珠粉中不含 .
(2)为了比较真假珍珠粉中碳酸钙的含量,共进行了三次实验,每次各取5g真假珍珠粉,分别置于如图2实验装置中(稀盐酸足量且真假珍珠粉中只有碳酸钙与稀盐酸会反应生成气体),测定生成气体体积数据如下表:
| 样品气体体积mL次数 |
第一次 |
第二次 |
第三次 |
| 假珍珠粉 |
117.50 |
117.28 |
117.05 |
| 真珍珠粉 |
111.52 |
111.66 |
111.86 |
①量气管中水面上方加一层植物油的目的是 ,由实验数据可知:真珍珠粉中碳酸钙的含量 假珍珠粉(填“>”、“<”、“=”).
②根据三次测量结果,取平均值,算得5g真珍珠粉生成的气体质量为0.22g,求:真珍珠粉样品中CaCO3的质量分数.
如图是稀盐酸和氢氧化钠溶液,其中一种物质逐滴加入另一种物质过程中溶液酸碱度的变化情况.

(1)该实验操作是将 滴加到另一种溶液中.
(2)图中 点时溶液中酸和碱恰好完全反应.
(3)若要将36.5克10%的盐酸全部反应完,需要NaOH多少克?(HCl+NaOH═NaCl+H2O)
环保石头纸的主要成分为碳酸钙,加入适量聚乙烯和少量胶合剂。
【实验一】 探究影响石头纸与盐酸反应快慢的因素
(1)甲、乙两同学设计实验如下:
| |
甲 |
乙 |
| 实验过程 |
 |
 |
| 现象 |
试管①、②、③中产生气泡快慢的顺序为:①>②>③。 |
|
| 分析结论 |
Ⅰ 碳酸钙与稀盐酸反应的化学方程式为 ; Ⅱ 对比甲同学实验①②可知, ,化学反应的速度越快; Ⅲ 对比甲同学实验 (填实验序号)可知,反应物的接触面积越大,反应速率越 。 Ⅳ 乙同学的实验中,应该连续记录的实验数据是 和 。 |
【实验二】 测定石头纸中碳酸钙的质量分数 提示:石头纸中其他成分均不与盐酸反应,也不溶于水。
(2)甲组同学:图Ⅰ为石头纸与稀盐酸反应的装置,图Ⅱ用于测量通常状况下CO2的体积。

①实验前首先要 ;
② 图Ⅱ装置中油层的作用是 ;
③ 反应完成后,先 (填具体操作),然后才能准确读得量气管中的CO2的体积。
④根据V CO2和ρCO2计算出CO2的质量,计算碳酸钙质量。
(3)乙组同学:均匀称取四份样品分别和稀盐酸反应,用电子天平及有关装置,得出二氧化碳质量,实验数据记录如下表。
| |
第1份 |
第2份 |
第3份 |
第4份 |
| 取样品质量(g) |
6.25 |
6.25 |
6.25 |
6.25 |
| 取稀盐酸的体积(mL) |
10.0 |
20.0 |
30.0 |
40.0 |
| 产生气体的质量(g) |
0.88 |
1.76 |
2.20 |
m |
通过对数据的分析和比较,回答下列有关问题
①在第 份样品的实验中,样品中碳酸钙完全反应了; 。
② m的值为
③石头纸样品中碳酸钙的质量分数是多少?(请写出计算过程)
某品牌可乐由水、白砂糖、焦糖色素(使可乐显黑褐色)、磷酸(H3PO4)等,按一定比例混合并压入二氧化碳配制而成。某同学为了探究可乐的成分及其含量,进行如下实验。
实验一 可乐中二氧化碳的定性检验
(1)请完成下表:
| 实验步骤 |
实验现象 |
结论 |
| 打开一塑料瓶装可乐,塞上带导管的橡胶塞,把导管插入(填化学式)溶液中 |
观察到 | 可乐中含有二氧化碳 |
实验二 可乐中磷酸的定量测定
测定过程如下:

(2)步骤①用活性炭浸泡的目的是。
(3)步骤③煮沸10分钟的目的是除尽滤液中的。
(4)已知步骤④反应的化学方程式为
,测得共消耗0.1%的NaOH溶液20g,忽略可乐中其它成分对测定结果的影响,计算可乐中磷酸的含量(以g/L为单位。相对分子质量:
-98;
-40),写出计算过程。
(5)如果步骤②缺少洗涤,则测定结果(填"偏高""不变"或"偏低")。
兴趣小组的同学探究一瓶敞口放置的NaOH溶液(原质量分数为10%)是否变质,进行了下述实验:
| 同学 |
小柯 |
小江 |
小龙 |
| 操作 |
各取一支相同规格的试管,在试管中加入一定量的待测溶液 |
||
| 滴入无色酚酞 |
加入足量的 ? |
加入足量的BaCl2溶液 |
|
| 现象 |
变红 |
产生气泡 |
产生白色沉淀 |
| 结论 |
没变质 |
变质 |
变质 |
(1)小江加入的"?"是。
(2)小江认为小柯的实验和结论不正确,理由是。
(3)小龙将沉淀过滤、洗涤、干燥,称量质量为1.97
。已知小龙所取的待测溶液质量为10
,请根据化学方程式计算,该待测溶液中变质生成物的质量分数。
"东方之星"沉船事故的发生牵动了亿万人民的心,几百名潜水员参与了救援工作,他们佩带的水下装备中有供氧装置,其原理是利用过氧化钠与人体呼出的二氧化碳和水蒸汽反应生成氧气,反应如下:
(1)已知潜水员携带的供氧装置中装有3.9kg的过氧化钠,潜水员在水下工作时每分钟消耗氧气约为6.67g,由此求得潜水员最多能在水下工作小时。(计算结果保留整数,以上数据均为模拟)
(2)若将39g的过氧化钠与69g水充分反应(已知水在反应中过量),求算所得溶液的溶质质量分数?
四氯化硅(
)是一种 重要的化工原料,遇水会发生如下反应:
某地曾发生将含有四氯化硅的废料倒入池塘造成污染的事件,事后环保人员在受污染的池塘中投放熟石灰〔
〕作了有效处理。
(1)已经
不跟
反应,为了确定投入熟石灰的质量,要先测定废料倒入池塘后生成盐酸的质量。选用下列哪组数据能确定池塘中生成
的质量
A.倒入废料的总质量、废料中
的质量分数
B.池塘水的
C.池塘水中
的质量分数
(2)经测定池塘水中共有0.365吨盐酸,则需要加入多少吨熟石灰才能将其完全反应。
(列式计算,相对原子质量:
:1
:16
:35.5
:40)
(7分)某校化学兴趣小组的同学开展了测定Na2CO3和NaCl的固体混合物中Na2CO3质量分数的探究实验。他们设计了如下的实验方案:
(1)“操作1”的名称是___________,溶液M中的溶质 (写化学式)。
(2)滴加CaCl2溶液应“过量”,否则可能会使测定的结果 (填“偏大”或“偏小”),确定CaCl2溶液是否过量的方法是 。
(3)该混合物中Na2CO3的质量分数是多少?(写出解题过程,计算结果精确到0.1%)
我国北方某盐湖生产的纯碱(Na2CO3)产品中常含有少量的氯化钠(其他杂质忽略不计),为测定该产品中碳酸钠的质量分数,现称取6g试样放在烧杯中并滴入稀盐酸,当盐酸滴加至36.5g时,烧杯内溶液的总质量为40.3g(假设产生的气体全部逸出),产生气体的质量与滴入稀盐酸的质量关系如图所示,试计算:
(1)A点产生气体的质量m= 。
(2)B点时,烧杯内溶液中的溶质是 (写出化学式)。
(3)试样中碳酸钠的质量分数(结果精确至0.1%)。
(10分)我国著名化学家侯德榜发明的“联合制碱法”主要原理是:I.向浓氨水中通入足量的CO2,使氨气、水和CO2发生化合反应而生成NH4HCO3溶液;II.向所得溶液中加入食盐细粒,充分搅拌,会析出溶解度较小的小苏打固体并得到化肥溶液;III.加热析出的固体制取纯碱。此法经过调整并应用于化工产业,某化工企业的工艺流程示意图如下:
请完成下列填空:
(1)“联合制碱原理II”中发生反应的化学方程式为 。
(2)在如图的流程中,先加Ca(OH)2溶液的目的是 ,再加入Na2CO3溶液的目的是 。
(3)“操作1”的名称是 ,“氨化溶液”后,溶液的pH 7(填:“大于”、“小于”或“等于”),从而有利于吸收“气体A”,气体A为 (填名称)。
(4)利用“270℃以上小苏打完全分解,纯碱受热不分解”的性质,化学兴趣小组的同学对实验室所购纯碱(假设所含杂质均为小苏打)进行了如下实验:称取20.00g干燥的固体样品放入坩埚,300℃恒温加热至质量不变,在干燥器中冷却后称量残留固体质量为19.38g。
根据题目所给信息,计算该样品中纯碱的质量分数(写出计算过程)。
现有一瓶久置的标有质量分数为10%的NaOH溶液样品,为探究其变质(NaOH易和空气中的CO2反应生成Na2CO3)的相关问题,利用U形管设计如下图所示的装置进行实验。
(1)如图甲所示,若此溶液变质,分别在U形管的两端滴入HCl溶液和澄清的石灰水时,观察到的现象:a端______ __ __,____ _______,b端___________________。
(2)如图乙所示,取此NaOH样品溶液20g放于U形管中,并在其中加入适量的酚酞试液,通过分液漏斗向U形管中滴入HCl溶液,当滴入20gHCl溶液时,恰好反应完全。
①滴入稀盐酸过程中,U形管中的溶液颜色变化为______________________________。
②恰好完全反应时,生产气体0.22g,试计算该溶液中Na2CO3的质量分数。
同学在帮助老师整理实验室时,发现了半瓶久置的氢氧化钙粉末,他们决定对这瓶氢氧化钙粉末的组成进行实验探究.
(1)提出问题:这瓶氢氧化钙是否已经变质?
(2)猜想与假设:该氢氧化钙粉末的成分为
I.氢氧化钙;
II.氢氧化钙、碳酸钙;
III._____①_________.
(3)设计方案、进行实验:请你参与探究,并填写下表
(4)联想与启示:氢氧化钙变质的原因___________⑤_________(用化学方程式表示),因此氢氧化钙应___⑥_____保存.
(5)【定量分析】为了进一步探究该氢氧化钙样品中各成分的质量,小组同学称取氢氧化钙样品12.4g于锥形瓶中,加入32.6g水,振荡形成悬浊液,向锥形瓶中逐滴滴加的稀盐酸,使其充分反应至无气体产生,测得加入盐酸的质量与锥形瓶中物质的质量关系如下表所示。
| 加入盐酸的质量/g |
0 |
25 |
37.5 |
| 锥形瓶中物质的质量/g |
45 |
70 |
80.3 |
(I)根据表中数据分析,加入盐酸的质量在0到25克时,仅有_⑦___与盐酸反应
(II)试求12.4g该样品中各成分的质量.
硅钢是变压器、充电器中的核心材料,其主要成份是Fe和Si。某学生用硅钢样品做了如下实验:取4.2g硅钢样品,将60g稀硫酸分6次加入样品中(其中稀硫酸与硅及其它杂质不反应),充分反应后过滤、洗涤、干燥、称重,得到的实验数据如下:
| 实验次数 |
一 |
二 |
三 |
四 |
五 |
六 |
| 稀硫酸的用量/g |
10 |
10 |
10 |
10 |
10 |
10 |
| 剩余固体的质量/g |
M |
2.8 |
2.1 |
1.4 |
0.7 |
0.7 |
(1)从以上数据可知,稀硫酸加入第______次充分反应后,铁恰好完全反应。
(2)表格中M=__________。
(3)计算所用稀硫酸中溶质的质量分数。
(13分)钠的化合物在日常生活中应用广泛.
(1)碳酸氢钠是发酵粉的成分之一,其俗称是 .
(2)氯化钠是重要的调味品,通过以下化学反应均能生成NaCl.
反应一:钠在氯气中燃烧.反应的化学方程式为 .
反应二:NaOH溶液与稀盐酸反应.关于该反应,下列说法正确的是
| A.该反应是中和反应 |
| B.将一定量的稀盐酸逐滴滴入NaOH溶液中,pH不断减小,说明两者发生了反应 |
| C.将一定量的稀盐酸滴入滴有酚酞的NaOH溶液中,溶液仍为红色,说明两者不反应 |
| D.将一定量的稀盐酸与NaOH溶液混合后溶液的pH=7,说明两者发生了反应 |
E.将NaOH固体放入稀盐酸中,放出热量,说明两者发生了反应
反应三:用Na2CO3溶液和稀盐酸混合.反应的化学方程式为: .
充分反应后的溶液中一定有NaCl,可能有Na2CO3或盐酸.
①为确定反应后溶液中的溶质,同学们进行了如下实验:
步骤I、确定溶液中是否含有盐酸:
甲同学选用了酸碱指示剂中的 试液;
乙同学选用了镁粉,通过实验观察到 ,确定溶液中一定没有盐酸.
步骤II、通过实验确定溶液中含有Na2CO3
②欲从反应后溶液中得到纯净的NaCl,丙同学设计了如下实验方案:
| 方案 |
加入试剂 |
分离方法 |
方案评价 |
| 一 |
适量Ba(OH)2溶液 |
过滤、蒸发结晶 |
不可行,理由是: |
| 二 |
适量的 |
|
可行 |
(3)(4分)过氧化钠(Na2O2)是供氧设备中常用的供氧剂.韩国“岁月号”沉船事故发生后,
几百名潜水员携带水下供氧设备参与了打捞工作.过氧化钠与水的反应为:2Na2O2+2H2O═4NaOH+O2↑.现将15.6g过氧化钠加入盛有147.6g水(过量)的烧杯中充分反应,直至固体完全消失,不再有气泡产生.
请计算:①反应生成的氧气质量;②反应后所得溶液中溶质的质量分数.(写出计算过程)
某同学取2.5g石灰石,滴加30g稀盐酸,所产生的气体质量与滴入盐酸质量的关系如下图所示。
试根据图中数据计算:
Ⅰ.反应生成二氧化碳的物质的量为 (19) mol.
Ⅱ.石灰石中碳酸钙的质量分数(根据化学方程式计算)。(20)
Ⅲ.该反应结束后,所得溶液中滴加石蕊试液,可观察到现象是 (21) 。
试题篮
()