科学兴趣小组在调查一化工厂时,发现有个车间排出的废水澄清透明,呈黄色.为测定该废水中所含的物质,他们进行如下实验(假设能发生的反应均恰好完全反应):
(1)用pH试纸测试,测得pH为2.
(2)取一定量废水溶液,加入Ba(NO3)2溶液,无现象.
(3)另取一定量废水溶液,加入AgNO3溶液后,过滤,得到白色沉淀A和滤液.
(4)向滤液中加入NaOH溶液,得到红褐色沉淀B.
由此可知:该废水溶液呈 性;所得的红褐色沉淀B为 ;废水溶液中肯定含有的盐是 .
下列变化中有一种变化与其它三种变化不同的是
| A.浓盐酸打开瓶塞,瓶口形成白雾 |
| B.浓硫酸敞口放置,溶液质量增加 |
| C.盛石灰水的试剂瓶壁产生一层白膜 |
| D.滴有酸酞的氢氧化钠溶液中加入木炭后红色消失 |
某矿石由MgO、Fe2O3、CuO和SiO2组成,用它制备氢氧化镁的流程图如下所示:
(1)写出Fe2O3与盐酸反应的方程式:______________________________,此反应常用来除铁锈;写出一条预防钢铁锈蚀的方法:__________________________。
(2)在溶液A中加入熟石灰调节溶液的pH,可以使溶液中的金属阳离子转化为沉淀。该实验条件下,使金属阳离子沉淀的相关pH数据见下表。为保证产品纯度、减少产品损失,并便于操作,溶液B的pH可容许的范围为__________。
| 氢氧化物 |
 |
 |
 |
| 开始沉淀的pH |
1.5 |
4.2 |
8.6 |
| 完全沉淀的pH |
3.2 |
6.7 |
11.1 |
(3)溶液B中一定含有的溶质为__________(填化学式)。
(4)写出溶液B中加入熟石灰,生成产品的化学方程式:____________________。
如右图所示,打开止水夹,将液体A滴入试管②中与固体B接触,若试管①中的导管口有气泡产生,则液体A和固体B的组合不可能是
| A.稀盐酸和锌粒 | B.过氧化氢溶液和二氧化锰 |
| C.水和氢氧化钠 | D.水和硝酸铵 |
对于稀硫酸而言,溶质的质量分数越大,溶液的酸性越强.常温下,20%的稀硫酸的pH (填“大于”“小于”或“等于”)10%的稀硫酸的pH。如果要使10%的稀硫酸的pH升高,可采取如下方法:
(1)发生化学反应的方法:可以加入的物质是(要求物质的类别不同) 、 。
(2)通常类别相同的物质具有相似的化学物质,稀盐酸、稀硫酸有许多相似的化学性质,是因为_____。
(3)【查阅资料】资料一:已知复分解反应CaCO3 +2HC1= CO2↑+ H2O + CaCl2可自发进行。在常温下,测得浓度均为a%的下列六种溶液的pH大小情况:
表中pH大小情况揭示出复分解反应的一条规律,即较强酸发生类似反应可以生成较弱酸。下列反应均能发生,其中不符合该规律的是(填字母)_______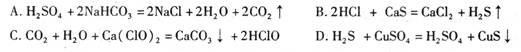
根据事物的某些相似性类推其他的相似性,并预测类似的可能性,是我们经常使用的一种思维方法。以下类推结果与实际相符的是
①酸性溶液能使紫色石蕊试液变红,所以能使紫色石蕊试液变红的溶液一定呈酸性
②硝酸铵溶于水吸热,说明硝酸铵溶解时只有吸热过程没有放热过程
③浓盐酸试剂瓶敞口久置后变稀且质量减轻,所以浓硫酸敞口久置也变稀且质量减轻
④将5g某物质完全溶解在95g水中,所得溶液的溶质质量分数一定为5%
| A.①④ | B.②③④ | C.① | D.①②③④ |
下列关于物质的组成、结构、性质及变化规律的总结,正确的是
| A.H2O、HCl、NaNO3均由不同种元素组成,属于混合物 |
| B.Fe、Fe2+、Fe3+三种微粒的质子数相同,化学性质也相同 |
| C.浓H2SO4、NaOH都具有吸水性,故它们都能用来干燥二氧化碳气体 |
| D.H2SO4、HCl都能使紫色石蕊试液变红色,是因为都含H+离子 |
下列有关酸的性质说法正确的是
| A.浓盐酸、浓硫酸都能使纸张炭化 |
| B.稀盐酸和稀硫酸都可用于除铁锈 |
| C.浓盐酸、浓硫酸都可用来干燥氧气 |
| D.打开盛有浓盐酸和浓硫酸的试剂瓶瓶塞,在瓶口都有白雾 |
下列图象能正确反映其对应关系的是

| A. | 向等质量、等浓度的稀硫酸中分别加入过量的 和 |
| B. | 向含有少量 的 溶液中逐滴加入稀盐酸 |
| C. | 用等质量、等浓度的过氧化氢溶液在有、无催化剂条件下制取氧气 |
| D. | 一定温度时,向一定量的饱和石灰水中加入生石灰 |
用盐酸可以清除铁锈(主要成分为Fe203),盐酸中主要含有H20分子、H+、c1﹣.某探究小组为探究稀盐酸中的哪种微粒能使氧化铁溶解,设计了如下实验方案,得出了初步结论.
(1)请填写下表中的实验结论:
| 实验过程 |
实验现象 |
实验结论 |
| 向盛有少量Fe2O3的试管中加入NaCl溶液振荡 |
固体不溶解 |
|
(2)是否需要做“向Fe2O3,中加入水”的对比实验?为什么?
小红、小王、小林、小张四位同学在学习酸碱盐性质的时候,进行了以下的实验:
(1)小红同学将酚酞试剂滴加到Ba(OH)2溶液中,观察到溶液变成 ,得出可溶性碱能使酸碱指示剂变色;
(2)小王同学将过量的稀HCl加入到甲同学所得溶液中,观测到红色褪去,
此时溶液中含有的溶质有 (除酸碱指示剂外)。
(3)小林同学认为碱除了能够跟酸反应外还能够跟一些非金属氧化物反应,例如三氧化硫就能跟Ba(OH)2溶液反应,请写出其反应的化学方程式 。
(4)小张同学将Na2CO3溶液加入到Ba(OH)2溶液,充分反应后,与乙同学得到的溶液混合,静置后发现,上层清液无色透明,底部有白色沉淀。丁同学反应后所得溶液中的溶质是 (除酸碱指示剂外) 混合后上层清液中一定含有的溶质是 (除酸碱指示剂外),可能含有的溶质是 。
下图能正确反映其对应操作中各量的变化关系的是
| A.向澄清石灰水中不断通入二氧化碳 |
B.向饱和 溶液中不断加入 溶液中不断加入 固体 固体 |
| C.高温加热碳和氧化铜的混合物,恰好完全反应生成铜和二氧化碳 |
| D.氢氧化钠溶液中加足量的水稀释 |
某 样品在生产过程中可能含有残余的
样品在生产过程中可能含有残余的 、
、 和
和 三种物质中的一种或几种,现按下图所示进行检验,出现的现象如图中所述。(设过程中所有发生的反应都恰好完全进行,微溶性物质视为完全溶解)
三种物质中的一种或几种,现按下图所示进行检验,出现的现象如图中所述。(设过程中所有发生的反应都恰好完全进行,微溶性物质视为完全溶解)
试根据实验过程和发生的现象,回答下列问题:
(1)沉淀 A 是 (写化学式)
(2)实验步骤①的现象可以说明混进的物质有 (写化学式)
(3)实验证明,溶液 B 中一定存在的溶质是 (写化学式)
(4)实验过程③中发生反应的化学方程式为 。
(5)上述实验现象还不能确认 是否残留在了
是否残留在了 样品中,请你利用溶液D进行实验确认判断:(说明选用试剂、现象和结论) 。
样品中,请你利用溶液D进行实验确认判断:(说明选用试剂、现象和结论) 。
硅钢是变压器、充电器中的核心材料,其主要成份是Fe和Si。某学生用硅钢样品做了如下实验:取4.2g硅钢样品,将60g稀硫酸分6次加入样品中(其中稀硫酸与硅及其它杂质不反应),充分反应后过滤、洗涤、干燥、称重,得到的实验数据如下:
| 实验次数 |
一 |
二 |
三 |
四 |
五 |
六 |
| 稀硫酸的用量/g |
10 |
10 |
10 |
10 |
10 |
10 |
| 剩余固体的质量/g |
M |
2.8 |
2.1 |
1.4 |
0.7 |
0.7 |
(1)从以上数据可知,稀硫酸加入第______次充分反应后,铁恰好完全反应。
(2)表格中M=__________。
(3)计算所用稀硫酸中溶质的质量分数。
试题篮
()