要除去下列物质中混有的少量杂质(括号内为杂质),所用的试剂或方法正确的是()
| A. | ( )-在空气中灼烧 | B. | ( )-适量稀盐酸 |
| C. | ( )-足量稀硫酸 | D. |
(
)-通过过量氢氧化钠溶液
|
下列各组溶液混合,能发生化学反应,并且一定能得到无色透明溶液的是( )
| A. | , , | B. | , , |
| C. | , , | D. | , , |
维生素C易溶于水,水溶液显酸性,易被氧气、碘氧化;某同学为了探究VC的性质,进行了如下实验.
Ⅰ、用某制药厂生产的VC片(每片含VC0.1g及不溶性辅料)配制0.5%的VC溶液。
(1)若取5片VC片,应大约去蒸馏水 mL.(取整数)
(2)除去浑浊液中的不溶性辅料,得到澄清的VC溶液,其操作名称是 。
Ⅱ、设计实验证明VC溶液具有酸性。
(3)限用试剂:无色酚酞试液、稀氢氧化钠溶液。请你完成下表。
| 实验步骤 |
预期现象及结论 |
| |
,说明VC溶液具有酸性 |
Ⅲ、探究VC溶液在一定温度下(18℃)露置时间对VC含量的影响,采用控制变量法进行试验,具体如下表所示。
| 实验序号 |
碘水浓度及用量 |
0.6%淀粉溶液 |
VC溶液恒温露置时间/h |
蓝色消失需要VC溶液滴数 |
| ① |
0.06%、4.8mL |
3滴 |
0 |
10 |
| ② |
0.06%、4.8mL |
3滴 |
12 |
12 |
| ③ |
3滴 |
24 |
18 |
|
| ④ |
0.06%、4.8mL |
3滴 |
36 |
41 |
(4)实验③中碘水的浓度及用量分别是 。
(5)VC质量分数随露置时间(0——36h)的变化图像,正确的是 (填字母标号) 
(6)为了提高定量探究vc溶液的准确性。配制VC溶液时,必须先除去溶解在蒸馏水中的少量氧气,具体处理方法是 。
有人用经过粉碎的含有较多有机物杂质的粗铜,通过下列步骤制取硫酸铜晶体
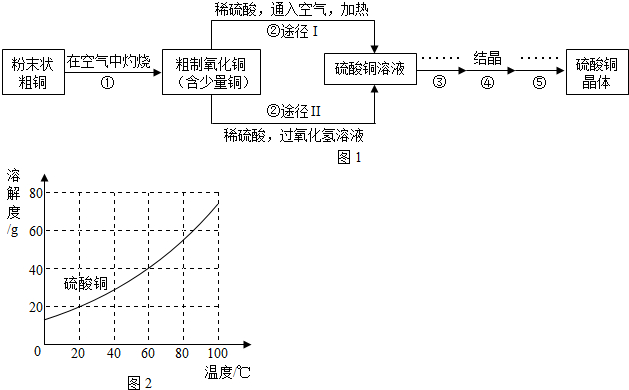
(1)若步骤①中灼烧温度过高会产生副产物氧化亚铜(铜的化合价为+1价),其化学式为。
(2)写出步骤②中氧化铜与稀硫酸反应的化学方程式:。
(3)步骤②中,铜和稀硫酸不能直接发生置换反应的原因是。
(4)反应途径Ⅰ和Ⅱ,分别发生如下反应:
途径Ⅰ:
途径Ⅱ:
请选择你认为更适合于实际应用的途径,并说明理 由:。
(5) 根据图2,步骤④的结晶方法为。
(6)若800
粗制氧化铜(其中单质铜的质量分数为4%),通过途径Ⅱ转化为硫酸铜,计算参加反映的过氧化氢的质量。写出计算过程。
取露置于空气中部分变质的NaOH样品配成溶液,向其中逐滴滴加过量的稀盐酸。能正确反映其变化的图像是
某化工厂生产过程中的残液含有硝酸银,取少量该残液样品,分别盛在
、
两支试管中,再分别加入不同质量的黄铜片(铜锌合金),充分反应后过滤,分别取滤渣工滤液进行下表所示实验.请你参与实验探究:
(1)用化学式填写下列实验报告中的空格:
| 实验操作 |
实验现象 |
分析与结论 |
| ①将
试管滤出的滤渣洗涤后,取样,再加入稀盐酸 |
有无色气泡产生 |
从 试管得到的滤渣的成分是 |
| ②取少量
试管得到的滤液,滴加少量稀盐酸 |
无明显现象 |
从 试管得到的滤液中的溶质一定有,可能有 |
(2)若要验证 试管得到的滤液中可能含有的溶质,可以采用的物理方法是;可以采用的化学方法是向滤液中加入(填写一种物质的化学式),并观察现象.
A是一种黑色难溶于水的氧化物。请分析如下转化关系并填空。
(1)用化学式表示:A C
溶液B中的溶质是 溶液D中的溶质是
(2)用化学方程式表示:① A + 硫酸 ② 蓝色溶液B + 铁粉
小张同学得知我国早在西汉时期,就能利用铁单质与硫酸铜溶液反应制取铜,其反应的化学方程式为.他利用硫酸铜进行趣味实验,将浸泡了色硫酸铜溶液的滤纸在酒精灯火焰上点燃,观察到滤纸颜色变白,由湿变干后燃烧.在燃烧后的灰烬中出现红色固体.他很好奇,进行了相关探究,请你参与并填写有关空白.
【提出问题】
红色固体是什么物质?它是如何产生的?
【查阅资料】
(1)温度达200℃时,
开始分解生成
和另一种氧化物;此反应前后各元素的化合价保持不变.
(2)温度超过1000℃,
才分解生成氧化亚铜(
);
呈红色.
【作出猜想】红色固体①可能是
;②也可能是
;③还可能是的混合物.
【实验探究】
(1)取红色固体观赏,呈亮红色;
(2)取少量红色固体于试管中,加入稀硫酸,固体不溶解,溶液仍为无色.
【分析推理】
(1)请教老师后得知,如有
存在,加入稀硫酸会发生如下反应:
结合实验探究的现象,确定亮红色固体为,同时也说明滤纸燃烧时的温度低于(填序号)
A.200℃ B.1000℃
(2)滤纸主要是由碳、氢、氧三种元素组成的,经分析,产生红色固体的原因可能是滤纸在燃烧过程中产生的碳与分解产生的
发生反应,生成亮红色固体和二氧化碳,请写出该反应的化学方程式.
【交流讨论】
(1)将浸有硫酸铜溶液的滤纸点燃,刚开始不能燃烧,是因为.
(2)此实验中,
受热分解生成
和(填化学式).
物质除杂是化学实验中经常遇到的问题。
【方法探究】为除去二氧化碳气体中混有的少量一氧化碳,小明设计了三种方案。
| 实验方案 |
|
| 方案A |
 |
| 方案B |
 |
| 方案C |
 |
上述方案中有两个是合理的,写出合理方案中任意一个反应的化学方程式;
【方法提炼】上述两种合理方案体现了物质除杂的不同思路:
思路一:将杂质直接转化为所需物质;
思路二:将所需物质转化为中间物质,再将中间物质转化为所需物质。
【方法运用】
运用思路一:除去氯化镁粉末中混有的少量氯化钡,先加足量的水溶解,再向溶液中加入适量的溶液,过滤、蒸发,即得氯化镁固体。
运用思路二:除去氯化镁粉末中混有的少量氯化钡、氯化钠和硫酸钾。

步骤①中反应的化学方程式是,滤液
中一定含有的溶质是;
步骤②中反应的化学方程式是,滤液
中一定含有的阴离子是;
步骤③中乙溶液是(填化学式)溶液。
"东方之星"沉船事故的发生牵动了亿万人民的心,几百名潜水员参与了救援工作,他们佩带的水下装备中有供氧装置,其原理是利用过氧化钠与人体呼出的二氧化碳和水蒸汽反应生成氧气,反应如下:
(1)已知潜水员携带的供氧装置中装有3.9kg的过氧化钠,潜水员在水下工作时每分钟消耗氧气约为6.67g,由此求得潜水员最多能在水下工作小时。(计算结果保留整数,以上数据均为模拟)
(2)若将39g的过氧化钠与69g水充分反应(已知水在反应中过量),求算所得溶液的溶质质量分数?
A、B、C、D、E、F是初中化学常见的六种物质,按要求回答下列问题:
(1)A、B为两种气体,所含元素种类相同,A有可燃性.物质间满足如下转化关系:(部分反应物和生成物已省略,“→”表示转化关系,下同) A⇌B⇌C
①写出B转化为A的化学方程式 ;
②物质C可以是 (写一种即可);
(2)D为一种气体单质,E为氧化物,E能与一种金属氧化物反应生成F并放出大量的热.物质间满足如下转化关系: D⇌E⇌F
①写出F的俗称 ;
②写出E转化为D的化学方程式 .
化学兴趣小组以碱的性质为主题,进行探究学习,请完成下列问题.
(1)小组同学将无色酚酞溶液分别滴入
溶液、
溶液中,溶液均由无色变为色.
(2)
和
都能与二氧化碳反应,定出其中一个反应的化学方程式为.
(3)"具体"到"抽象"是化学学习的重要思想,通过对
和
性质的认识,抽象得出碱类物质有一些相似的化学性质,碱类物质有相似化学性质的本质原因是.
(4)将
溶液与
溶液反应后所得混合物进行过滤,向滤液中滴入几滴稀盐酸,无明显现象,则原滤液中溶质的组成可能是.
下列图形能正确反映实验事实的是()
| A. |
充分加热氯酸钾和二氧化锰的混合物 |
B. |
稀硫酸加入铁粉 |
| C. |
氯化钠溶液里加水 |
D. |
硫酸铜和硫酸混合液滴入氢氧化钠溶液 |
已知木炭还原氧化铜实验中发生的主要反应:
.化学兴趣小组对该实验产物(假设反应物已完全反应)作如下探究:
探究一:检验产物的成份
【提出问题】实验产物是暗红色固体,很难观察到紫红色固体.暗红色固体是什么?
【查阅资料】氧化亚铜(
)为红色固体;
.
【猜想与假设】暗红色固体除铜外还可能含有
.
【设计实验】取少量暗红色固体,加入稀硫酸,如果观察到现象:,说明暗红色固体含有
.
探究二:测定产物中
的含量

原理:
,称取一定质量的固体样品,用如图装置进行实验(固定装置略去,碱石灰为氧化钙和氢氧化钠的混合物),通过测定反应前后装置d的质量达到实验目的.
(1)装置a中用稀硫酸而不用稀盐酸,原因是;
(2)若不加装置e,实验结果会偏高,原因是;
(3)点燃酒精灯前涉及的部分操作如下,正确的顺序是
①打开K2,关闭K1 ②检查装置的气密性
③连接仪器 ④关闭K2,打开K1,通氢气一段时间
(4)还可通过测定反应前后装置(填"a"、"b"或"c")的质量达到实验目的.
试题篮
()