某同学欲测定草木灰中碳酸钾的含量,称取69 g试样于烧杯中,加入29.2g稀盐酸恰好完全反应,充分反应后,称得混合物的总质量为93.8 g(忽略二氧化碳的溶解对质量的影响)。请计算:
(1)反应过程中产生的二氧化碳质量为 g。
(2)该草木灰试样中碳酸钾的质量分数。
现有一包只含氯化钙杂质的粗盐样品。某校化学兴趣小组的同学为测定该粗盐样品中氯化钙的质量分数,称取该食盐样品10g,充分溶解于100ml水中,(水的密度为1g/㎝3).在滴加适量的碳酸钠溶液,产生沉淀的质量与加入碳酸钠溶液的质量关系如下图所示。试计算:
(1)该粗盐样品中氯化钙的质量分数。
(2)过滤后所得滤液中溶质的质量分数。(精确到0.1%)。
现代社会的生产生活需要消耗大量能源。“高能气”
是今年才上市 的一种新燃料,其分子式可表示为( CXHy)。它具有燃烧充分,火力猛,气
的一种新燃料,其分子式可表示为( CXHy)。它具有燃烧充分,火力猛,气
化快,且不受环境湿度的影响等优点。但由于价格比较贵,一般在大饭店中才使用,家 庭
庭
燃料中还未推广。
(1)“高能气”属于_____化合物。(填“无机”或“有机”)
(2)经过实验测定:该化合物中碳元素与氢元素的质量比为9:2,试推算该化合物的化学式为_____
(3)试计算多少克“高能气”中含碳元素3.6克?(写出计算步骤)
某研究性学习小组为测定铜锌合金中铜的质量分数,进行如下实验:取合金10g,向其中不断加入稀硫酸,产生的气体与所加稀硫酸的质量关系如图所示。求:
①稀硫酸中溶质的质量分数。
②合金中铜的质量分数。
发射通信卫星的火箭用联氨(N2H4)做燃料,用四氧化二氮(N2O4)助燃,生成物不会对大气造成污染。
(1)反应的化学方程式为2N2H4+N2O4=3 +4H2O,请在横线上填写化学式以完成该化学方程式。
(2)请计算9.6gN2H4完全燃烧需要助燃物N2O4的质量。
利用废铁屑与一定质量分数的稀硫酸反应制取硫酸亚铁。现有80g废铁屑与430mL20%的稀硫酸(密度为1.4g/cm3)恰好完全反应(假设废铁屑中除铁以外的物质不溶于水且不与稀硫酸反应)。我能完成下列计算(结果保留整数):
⑴稀硫酸中溶质的质量;
⑵废铁屑中铁的质量;
⑶恰好完全反应时所得溶液中溶质的质量分数。
用“侯氏联合制碱法”制取的纯碱(Na2CO3)中常含
有少量的氯化钠。化学实验小组同学为测定某厂生产的纯碱中碳酸钠的含量,称取12g样品
放入烧杯中并滴加稀盐酸,当盐酸滴加至73g时,气泡不再冒出,此时称得烧杯内溶液的总
质量为80.6g。试计算:
⑴产生二氧化碳气体的质量是 g。
⑵该厂生产的纯碱中碳酸钠的质量分数。(计算结果精确到0.1%)
氢气还原氧化铜实验得到的固体粉末为氧化铜和铜的混合物,科学兴趣小组的同学对该粉末中单质铜含量进行测定,三组同学各取10克粉末样品置于烧杯中,然后加入不同质量的稀硫酸,充分反应后,对烧杯中剩余固体进行称量,实验数据记录如下:
| 组别编号 |
样品质量(克) |
加入稀硫酸质量(克) |
剩余固体质量(克) |
| 1 |
10 |
20 |
8.4 |
| 2 |
10 |
30 |
8 |
| 3 |
10 |
40 |
8 |
(1)分析表中数据可知,第2组实验中的剩余固体是 。(写出物质名称或符号)
(2)样品中单质铜的质量分数为 。
(3)加入的稀硫酸溶质质量分数是多少?(写出计算过程)
根据右图浓盐酸的商标,回答下列问题
(1)某研究小组的同学欲用该盐酸配制100g10%的稀盐酸,需该盐酸 g(保留一位小数),配制时应选用 (填“10ml”或“50ml”)量筒量取。
(2)小组同学用所配制稀盐酸来测量水垢【主要成分为CaCO3和Mg(OH)2】中CaCO3的质量分数:取10.0g水垢,加入所配100g10%的稀盐酸中,测得各时间段内生成气体的质量如下表:
通过实验,计算该水垢中CaCO3的质量分数。
宇航员在太空舱中,往往可利用自己呼出的二氧化碳与过氧化钠粉末作用来获得所需的氧气,并合理处理呼出的二氧化碳。(反应方程式为2Na2O2+2CO2===2Na2CO3+O2)假如某宇航员在某次太空飞行中预计消耗氧气480kg,则该宇航员应在太空舱中至少准备多少克过氧化钠。(要求写出计算过程)
氢气还原氧化铜实验得到的固体粉末为氧化铜和铜的混合物,科学兴趣小组的同学对该粉末中的单质铜的含量进行测定。三组同学各取10克粉末样品置于烧杯中,然后加入不同质量的同浓度的稀硫酸,充分反应后,对烧杯中剩余固体进行称量。实验数据记录如下:
| 组别 |
样品质量(克) |
加入稀硫酸质量(克) |
剩余固体质量(克) |
| 1 |
10 |
20 |
8.4 |
| 2 |
10 |
30 |
8 |
| 3 |
10 |
40 |
8 |
(1)分析表中数据可知,第2组实验中剩余固体是 。(写出物质名称或符号)
(2)样品中单质铜的质量分数为 。
(3)加入的稀硫酸溶质质量分数是多少?(写出计算过程)
乙醇是一种清洁燃料,但在氧气不足时燃烧,会生成一氧化碳,现有207g乙醇与一定量的氧气点燃后发生如下反应:3C2H5OH+8O2点燃 XCO2+2CO+9H2O
(1)根据质量守恒定律可知:X= ;
(2)计算该反应生成一氧化碳的质量。
氯化钙钾石的化学式为KCl·xCaC12(x是CaCl2的系数)。它是一种天然的钾肥,溶于水后得到KCl与CaCl2的混合溶液。某化学兴趣小组为了测定氯化钙钾石中钾元素的质量分数,称取样品18.55g加水完全溶解得到KCl与CaCl2的混合溶液,向该溶液中逐滴加入Na2CO3溶液,产生的沉淀与加入Na2CO3溶液的质量关系如下图所示。请回答下列问题:
(1)写出Na2CO3与CaCl2反应的化学方程式 ▲ 。
(2)图中AB段表示的意义是 ▲ 。
(3)18.55g氯化钙钾石样品中:
①CaCl2的质量是 ▲ g;
②KCl的质量是 ▲ g;
③钾元素的质量分数是 ▲ 。
(4)所用N a2CO3溶液中溶质的质量分数是多少?(最后一问要求写出计算过程)
造纸是我国古代四大发明之一,它有效地推动了人类文明的发展。
(1)回收农田产生的秸秆作为造纸原料,可以减少焚烧秸秆带来的______污染。秸秆的主要成分是纤维素[(C6H1005)n],纤维素中C、H、O三种元素的质量比为______(用最简整数比表示)。
(2)造纸会产生大量含NaOH的碱性废水,需经处理呈中性后排放。
①检测废水呈碱性的简单方法是_____。
②若某造纸厂废水中NaOH的质量分数为l.6%,现有废硫酸9.8 t(H2SO4的质量分
数为20%),可以处理的废水质量是多少?(计算过程写在答题卡上)
如图所示,有人制作了一个家庭制氧装置。该制氧装
置由2个饮料瓶、2根软管和药剂构成,整套装置成本不到3块钱。药剂包括过氧碳酸钠(2
Na2 C03·3 H2 O2)和二氧化锰。制氧时,先在两个饮料瓶中加入适量的水,再往甲瓶中加入
药剂:产生的气体通过B管从乙瓶导出,即可供人吸氧。
(1)为了顺利地导出甲瓶中产生的氧气,A软管在甲瓶中应 ▲ 。(选填“不伸入液面’’或“伸人液面")
(2)药剂加入水中后会发生以下两个反应: 2 Na2 CO3·3 H2O2="2" Na2 CO3+3 H2O2;
2H2 O2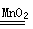 2 H2 O+O2↑从化学反应的基本类型来看,它们都属于 反应。
2 H2 O+O2↑从化学反应的基本类型来看,它们都属于 反应。
(3)已知一包总质量为110克的药剂可34克过氧化氢,则这包药剂完全反应会生成多少克氧气?
试题篮
()