对于化学反应:2A =" 2B" +C,已知:反应生成B和C的质量比为B∶C = 1∶8。请填空:
| 物质 |
A |
B |
C |
| 反应前质量/g |
100 |
0 |
5 |
| 反应后质量/g |
64 |
|
|
为测定某碳酸氢铵化肥中的含氮量,小滨在实验室里取用8.5 g该化肥样品与20g NaOH溶液共热,恰好完全反应,测得残留物为26.8 g(提示:反应的化学方程式为NH4HCO3+2NaOH="=" Na2CO3+2H2O+NH3↑,生成的氨气全部逸出,其他成分不含氮,也不参加反应)。试求:
(1)生成氨气的质量。
(2)该化肥中氮元素的质量分数(计算结果精确到0.1%)。
(3)所用溶液的溶质质量分数。
为了分析某生铁中铁的含量,学习小组的同学们进行了实验探究,即取6g生铁与10%的盐酸反应,加入盐酸质量与放出气体质量的关系如下表。(说明:生铁中杂质不溶于水,也不与盐酸反应)
| 盐酸质量/g |
36.5 |
73 |
109.5 |
146 |
| 气体质量/g |
0.1 |
0.2 |
0.2 |
m |
(1)上述表格中m的值为 ;
(2)该生铁中铁的质量分数为多少?(写出计算过程,最终结果保留到0.1%)
甲型H1N1流感病毒正威胁着人类的健康和安全。“达菲”(C16H28O4N2)是目前世界上治疗甲型H1N1流感病毒的良药。生产“达菲”的主要原料是莽草酸,可从茴香中提取。请回答下列问题:
(1)“达菲”分子中,碳、氢、氧、氮四种元素的原子个数比为 ;
(2)“达菲”中,氢、氧、氮三种元素的质量比为 ;
(3)莽草酸完全燃烧,仅生成二氧化碳和水,则由此可推断莽草酸中一定含有 元素。
高温加热10g碳酸钙,一段时间后停止加热,测得剩余固体中钙元素的质量分数为50%。
(1)若10g碳酸钙全部分解可产生多少克氧化钙?
(2)实际反应生成的二氧化碳是多少克?
如图为A、B两种固体物质的溶解度曲线。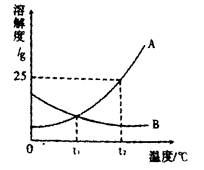
(1)在 ℃时,A、B两种物质的溶解度相等。
(2)t2℃时,100g水中溶解 gA物质恰好饱和,该饱和溶液中溶质的质量分数为 。若要把该饱和溶液稀释成质量分数为1 0%的溶液,应加水 g。
(3)t2℃时,分别将恰好饱和的A、B两种物质的溶液降温至t1℃,溶质的质量分数保持不变的是 。
某地一辆满载浓硫酸的罐车翻到,导致25
溶质的质量分数为98%的浓硫酸泄漏,并向路基两边蔓延,接到报警后消防官兵立即赶来并用石灰浆(主要成分为氢氧化钙)中和硫酸解除了险情。请回答:
(1)25
溶质的质量分数为98%的浓硫酸中含
的质量为;
(2)计算:中和泄漏的硫酸,理论上需要多少吨氢氧化钙;
(3)处理一定量的硫酸,理论上既可用
吨的氢氧化钙粉末,也可选用
吨的氧化钙粉末,还可用
吨碳酸钙粉末,则
、
、
的数值大小关系为。
医学上常用双氧水来清洗创口和局部抗菌。小美同学为了测定一瓶医用双氧水溶液的溶质质量分数,取该双氧水69
放入烧杯中,然后加入2
二氧化锰,完全反应后,称得烧杯内剩余物质的总质量为69.04
。请回答下列问题;
(1)二氧化锰在反应中的作用是,生成的氧气为
。
(2)该双氧水溶液的溶质质量分数。(写出计算过程)
市场上某补钙制剂的说明书如图所示,请计算:
(1)葡萄糖酸钙的相对分子质量为 。
(2)葡萄糖酸钙中碳、氢、氧、钙四种元素的质量比为 。
(3)葡萄糖酸钙中钙元素的质量分数为 (保留至0.1%)。
(4)按照说明书的用量,每天可补充 mg钙元 素?(精确到0.1)。
素?(精确到0.1)。
在烧杯中加入2.14
久置的铝箔,再滴加稀硫酸,放出气体的质量与所加稀硫酸质量的关系如右图所示。请回答下列问题:
(1)产生氢气
,刚开始滴加稀硫酸没有氢气放出的原因是。
(2)所滴加的稀硫酸中溶质的质量分数。
(3)铝箔中铝元素的质量。

(8分)氯化钙钾石的化学式为KCl·xCaC12(x是CaCl2的系数)。它是一种天然的钾肥,溶于水后得到KCl与CaCl2的混合溶液。某化学兴趣小组为了测定氯化钙钾石中钾元素的质量分数,称取样品18.55g加水完全溶解得到KCl与CaCl2的混合溶液,向该溶液中逐滴加入Na2CO3溶液,产生的沉淀与加入Na2CO3溶液的质量关系如下图所示。请回答下列问题:
(1)写出Na2CO3与CaCl2反应的化学方程式 ▲ 。
(2)图中AB段表示的意义是 ▲ 。
(3)18.55g氯化钙钾石样品中:
①CaCl2的质量是 ▲ g;
②KCl的质量是 ▲ g;
③钾元素的质量分数是 ▲ 。
(4)所用N a2CO3溶液中溶质的质量分数是多少?(最后一问要求写出计算过程)
造纸是我国古代四大发明之一,它有效地推动了人类文明的发展。
(1)回收农田产生的秸秆作为造纸原料,可以减少焚烧秸秆带来的污染。秸秆的主要成分是纤维素[
],纤维素中
三种元素的质量比为(用最简整数比表示)。
(2)造纸会产生大量含
的碱性废水,需经处理呈中性后排放。
①检测废水呈碱性的简单方法是。
②若某造纸厂废水中
的质量分数为l.6%,现有废硫酸9.8
(
的质量分数为20%),可以处理的废水质量是多少?(计算过程写在答题卡上)
⑴H2O2中氢、氧原子个数比为 ;
⑵在实验室里用68克溶质质量分数为5%的H2O2溶液与少量MnO2混合制取氧气,计算生成氧气的质量。
某化学兴趣小组,在一次查阅 "关于如何治疗人体胃酸过多"的资料后,决定利用实验室相关仪器(高温消毒)自制小苏打水(NaHCO3水溶液),用来缓解胃酸过多的症状。具体配制步骤(经医生建议)如下:
第一步:准确称量
食品级小苏打粉末;第二步:将第一步所称粉末配成
溶液;
第三步:将第二步所得溶液取出
,再加水配制成
溶液即得到治疗胃酸过多的
小苏打水(密度为
)。
请回答下列问题:
(1)第一步用到的主要仪器是;第二步使用的玻璃仪器有(至少写两种);
(2)第三步配制所得的小苏打水中
的质量分数是 ;
(3)胃酸过多者在医生的指导下,每次喝50mL第三步配制所得的小苏打水,一天两次,则一天可反应掉胃液中的
g。
在农业上,常需要用质量分数为16%的氯化钠溶液来选种。现需要配制200 这种溶液,需要氯化钠的质量 ,水的质量是 。(可能用到的相对原子质量: )
试题篮
()