已知:Al(OH)3沉淀可溶于NaOH溶液,其反应方程式为:Al(OH)3+NaOH═NaAlO2+2H2O,现向100 g HCl和AlCl3的混合溶液中逐滴加入质量分数为20%的NaOH溶液,产生沉淀的质量与所加NaOH溶液的质量关系如图所示。回答下列问题:
(1)原混合溶液中HCl的质量分数是 。
(2)当沉淀达到最大值时生成NaCl的质量是多少?
(3)m2= 。

化学兴趣小组的同学发现实验台上有一瓶标签残缺的试剂(如图),同学们对此进行了如下探究。
【提出问题】这是一瓶什么溶液?
【猜想与假设】海天同学的猜想是Na2SO3溶液;刘浩同学的猜想是Na2SO4溶液;你的猜想是 (写一种)。
【查阅资料】
Ⅰ白色沉淀BaSO3不溶于水,但要溶于稀盐酸。
Ⅱ硝酸具有强氧化性,能将BaSO3氧化成BaSO4。
ⅢNa2SO3与稀盐酸反应产生SO2,SO2能使石灰水变浑浊,也能使品红溶液褪色。
【进行实验】
Ⅰ海天同学取适量的该溶液于试管中,滴加稀盐酸,产生无色气体,他认为自己的猜想成立,而刘浩同学认为他的结论不合理,原因是 。
Ⅱ刘浩同学为了验证自己的猜想,做了如下实验:
取适量的该溶液于试管中,先滴加足量的BaCl2溶液,再滴加过量稀硝酸,现象为 ,刘浩同学认为自己的猜想成立。
Ⅲ卓玛同学对刘浩同学的猜想又提出了质疑,她认为加BaCl2和稀硝酸,Na2SO3也会产生沉淀,为了验证自己的观点,做了如下实验:
步骤 |
操作 |
实验现象 |
实验结论 |
步骤1 |
取少量该溶液于试管中,滴加足量的BaCl2溶液 |
|
无 |
步骤2 |
向步骤1的试管中滴加足量的稀盐酸 |
|
此溶液不是Na2SO4 |
步骤3 |
将步骤2中产生的气体通入品红溶液 |
品红溶液褪色 |
|
写出卓玛同学实验过程中的化学方程式: , 。

小吴对化学实验有浓厚的兴趣,设计了如下实验装置进行实验,按要求填空.

①仪器a的名称 ;可用于实验室制取O2的发生装置有 (填装置编号,下同);实验室制取CO2的发生装置有 ;用C装置收集CO2时,气体应从C装置的 端进入(填“b”或“c”).
②实验室制取H2的化学方程式为 .
③小吴D装置的溶液中滴入石蕊试液,发现溶液显蓝色,由此可知碳酸钠溶液呈 性(填“酸”、“碱”或“中”).
④小吴用E装置探究CO2能否与碳酸钠溶液反应,他做了两组对比实验:第一组用胶头滴管向广口瓶中加入2 mL水,发现气球鼓起不明显;第二组用胶头滴管广口瓶中加入2 mL一定质量分数的碳酸钠溶液,发现气球迅速鼓起.他得出的结论是:CO2能与碳酸钠溶液反应,该反应的化学方程式为 .
初中化学几种常见物质的相互转化关系如图所示,其中A为无色无味的有毒气体,B是赤铁矿的主要成分,F常用于改良酸性土壤,H为常见的液态化合物,K是一种紫红色单质。根据推断回答下列问题:
①E溶液的颜色为 ,反应Ⅰ~Ⅲ中属于置换反应的是 (填编号),化合物Na 2DO 4中D的化合价为 。
②写出反应Ⅰ的化学方程式 ,该反应在工业上的用途是 。
③写出一个由G制取C的化学方程式 。
④D与K的混合物7 g与足量的E溶液充分反应后,固体质量增加0.8g,则该混合物中D的质量分数为 。

X、Y、Z、W是初中化学常见的四种非金属元素.X的一种原子没有中子,Y的一种单质可用于制铅笔芯,Z是地壳中含量最高的元素,W2是空气中含量最高的单质.回答下列问题:
①Y的另一种单质是天然存在的最硬的物质,该单质的名称为 ,Z2﹣的离子结构示意图为 .
②X、Z、W三种元素可形成一种盐,该盐是一种常见的化肥,其化学式为 .
③实验室检验YZ2时发生反应的化学方程式为 .
④钠与Z形成的化合物Na2Z2常用作潜水艇中的供氧剂,因为Na2Z2与YZ2反应生成Na2YZ3和Z2,写出其反应的化学方程式 .
⑤X、Y、W三种元素可按质量比2:6:7形成一种的火箭燃料偏二甲肼,其相对分子质量为60,偏二甲肼在空气中完全燃烧的产物均无污染,其化学方程式为
.
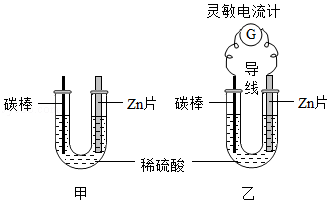
课堂上老师对探究干电池原理的实验进行如下改进。
图甲:把一块锌片和一根碳棒同时插入盛有稀硫酸的U型管中;
图乙:用导线将锌片和碳棒连接起来插入盛有稀硫酸的U型管中,并在导线中间连接一只灵敏电流计。
请按要求回答问题:
(1)甲主要的能量转化形式是 。
(2)乙观察到与甲不同的现象是 、 。
(3)配制所需硫酸:现有98%的浓硫酸18g(体积为9.8mL),可将其配成24.5%的硫酸溶液 g,配制的具体操作过程是 。
(4)取(3)所配24.5%的硫酸溶液20g,向其中滴加25%的Ba(OH)2溶液至恰好完全反应。
①请计算产生沉淀的质量 g,写出必要的计算过程。
②沉淀过滤后水的质量是 g。
空气是宝贵的自然资源,其组成如表
空气组成 |
X |
O2 |
Y |
CO2 |
其它 |
体积分数 |
78% |
21% |
0.934% |
0.034% |
0.002% |
如图是空气等为原料合成尿素[CO(NH2)2]的流程(部分产物略去)。请按要求回答相关问题: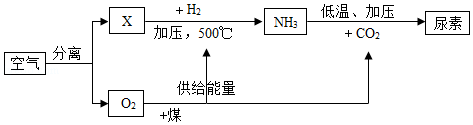
(1)X的分子式是 ,Y气体名称是 。
(2)煤的气化属于 变化。(选填“物理”或“化学”)。
(3)分离空气的常用方法有以下两种。
Ⅰ.将液态空气气化,首先分离出氮气。则沸点:X Y(选填“高于”、“等于”、“低于”)
Ⅱ.分子筛分离。分子筛是一种内部分布有均匀微小孔径的固体,通过特制的分子筛把空气中的氧分子吸入孔穴而与其它分子分离,则分子大小:X O2(选填“大于”、“等于”、“小于”)。
(4)结合流程和所学知识可以预测:化学反应中发生物质变化的同时一定还伴随有 变化。(选填“状态”、“能量”、“原子”、“压强”)
(5)写出NH3合成尿素的化学方程式 。
(6)相同条件下气体体积之比等于分子之比,则空气中氮分子与氧分子总质量之比等于 。
已知:CO2和SO2既有相似性也有差异性。请回答相关问题:
气体 |
CO2 |
SO2 |
||
制备 |
石灰石与盐酸 |
Na2SO3与70%硫酸 |
||
相似性 |
溶解性 |
能溶于水 |
易溶于水 |
|
与澄清石灰水反应 |
二者都产生白色浑浊 |
|||
差异性 |
与KMnO4溶液 |
不反应 |
气体被吸收,溶液逐渐褪色 |
|
(1)化石燃料的气体产物中有CO2和SO2等物质,其中SO2是形成 的主要物质(填一污染名称)。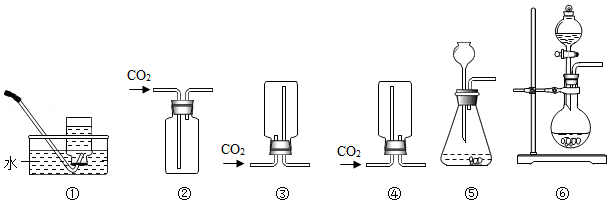
(2)制取CO2的化学方程式是 ,可用于收集CO2装置是 。(选填如图序号)。
(3)写出Na2SO3与70%硫酸反应的化学方程式 ,制备SO2发生装置用 。(选填如图序号)。
(4)将收集满SO2的试管倒扣在水中观察到的现象是 。
(5)结合已知信息,请你设计实验证明化石燃料燃烧的气体产物中有CO2(写出操作、试剂、现象、结论) 。
已知:铝在常温下能与O2反应,在铝表面形成一层氧化薄膜;Al2O3能溶于NaOH溶液。某课外小组对“铝与氯化铜溶液反应”进行如下探究。
①测得CuCl2溶液的pH<7;
②将铝片放入CuCl2溶液中,没有观察到现象;
③取出铝片用NaOH溶液浸泡一段时间,再取出铝片洗净后放入CuCl2溶液中,观察到铝表面产生无色气泡。
请回答下列问题:
(1)步骤①观察到CuCl2溶液呈 色,该溶液呈 性(选填“酸”、“碱”或“中”)。
(2)步骤③中还可能观察到的现象是 ,产生此现象的化学方程式是 。
(3)步骤②中没有现象的原因是 。
(4)小组对步骤③产生的气体提成以下猜想:
a.可能是Cl2; b.可能是O2; c.可能是 ;
小组讨论得出c成立,理由是 。
某碳酸钠样品中含有一定量的碳酸氢钠,为测定某纯度,取100g样品加热至不在产生气体(2NaHCO 3 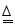 Na 2CO 3+H 2O+CO 2↑),使生成的水完全被浓硫酸吸收,测得加热时间和浓硫酸质量增加的关系如下表:
Na 2CO 3+H 2O+CO 2↑),使生成的水完全被浓硫酸吸收,测得加热时间和浓硫酸质量增加的关系如下表:
| 时间(min) |
0 |
1 |
2 |
3 |
4 |
| 仪器和浓硫酸的质量总和(g) |
150 |
150.9 |
151.8 |
152.7 |
152.7 |
回答下列问题:
(1)当完全反应后,生成水的质量为 g。
(2)样品中碳酸氢钠的质量分数是多少?
(3)若将加热后所得固体完全溶解于300g水中,计算所得溶液中溶质的质量分数。
有一黑色粉末物质可能由氧化铜、木炭、二氧化锰中的两种或三种组成。某兴趣小组对该粉末的成分进行了如下探究和验证。
【提出问题】该黑色粉末含有哪些成分?
【做出猜想】大家认为黑色粉末的组成共有下面四种可能:
猜想1:木炭和氧化铜;
猜想2:木炭和二氧化锰;
猜想3: ;
猜想4:氧化铜、木炭、二氧化锰。
【查阅资料】1.常温下碳、氧化铜、稀硫酸均不与二氧化锰反应;
2.MnO 2不能燃烧。
【探究验证】
| 步骤 |
实验操作 |
实验现象 |
结论 |
理由 |
| (1) |
取少量黑色粉末放入试管,加入足量的稀硫酸,振荡 |
黑色粉末部分溶解 |
相关反应方程式
|
|
| (2) |
将(1)反应后的物质过滤,干燥,取一部分滤渣放入横口试管中加强热,并不断鼓入空气 |
有火星产生 |
原混合物中含有
|
|
| (3) |
①将(2)所得另一部分滤渣加入5%的过氧化氢溶液 |
有大量能使带火星的木条复燃的气体产生 |
原混合物中含有
|
|
| ②向(2)所得滤液中加入5%的过氧化氢溶液 |
有大量能使带火星的木条复燃的气体产生 |
|
【结论】上述猜想中正确的是 。
如图是实验室的部分实验装置图,回答有关问题
(1)写出仪器名称:b是 。
(2)用A装置制取二氧化碳时长颈漏斗插入液面的原因是 。
(3)实验室用C装置加热高锰酸钾制取氧气时,需在试管口放一团棉花的原因是 ,其反应方程式为 。
某兴趣小组的同学为测定小苏打(碳酸氢钠)样品(只含有氯化钠一种杂质)的纯度,取样品9.3g逐滴加入稀盐酸,生成CO2气体的质量与滴加稀盐酸的质量关系如图所示.
试计算:(计算结果精确到0.1%)
(1)样品中碳酸氢钠的质量分数;
(2)恰好完全反应时,所得溶液中溶质的质量分数.

某校兴趣小组的同学准备进行常见酸、碱、盐的性质实验时,发现实验台上摆放的药品中有一瓶溶液的试剂瓶未盖瓶盖且标签破损(如图),于是决定对该瓶溶液进行实验探究:
【提出问题】这瓶溶液是什么溶液?
【获得信息】酸、碱、盐的性质实验中用到含有钠元素的物质是氯化钠、氢氧化钠、碳酸钠.
【做出猜想】:猜想一:这瓶溶液是氯化钠溶液;
猜想二:这瓶溶液是氢氧化钠溶液;
猜想三:这瓶溶液是碳酸钠溶液.
【实验推断】
(1)小明取样滴加无色酚酞溶液,溶液呈红色,得出结论:该溶液不可能是 溶液,原因是 .
(2)小李另取样滴加稀盐酸,观察到有气泡产生,由此得出结论:该溶液是碳酸钠溶液,反应的化学方程式是 .
(3)小王认为小李的结论不完全正确,理由是 .
大家讨论后一致认为还要进行如下实验:
【继续探究】另取样加入过量的CaCl2溶液,观察到有 产生,设计这一步骤的目的是 ,静置后,取上层清液,滴入酚酞溶液,溶液呈红色.
【实验结论】这瓶溶液是 .
【探究启示】实验取完药品后应立即盖好瓶塞,且取用药品时标签向着手心.
【拓展迁移】若该溶液与盐酸发生中和反应,恰好完全反应的微观过程如图2所示,反应实质是 .
如图是实验室制取和收集气体的常用装置.

(1)写出仪器①的名称 .
(2)实验室用A装置加热高锰酸钾制取O 2的化学反应方程式为 ,还应对该装置进行的改进是 .
(3)张老师要制取一瓶氯气(Cl 2)做演示实验,反应原理是MnO 2+4HCl(浓)  MnCl 2+Cl 2↑+2H 2O.
MnCl 2+Cl 2↑+2H 2O.
已知常温下,氯气是一种黄绿色有刺激性气味的有毒气体,密度比空气的大,易与水反应生成盐酸和次氯酸(HClO).张老师应选择的发生装置是 (填装置的字母代号),写出氯气与水反应的化学方程式 ,为防止对环境的污染,此装置还需 .
试题篮
()