"氧泡泡"系列产品去污能力强、绿色环保,已成为中国氧系清洁品类领导品牌,其主要成分是过碳酸钠(2Na 2CO 3•3H 2O 2)。某化学活动小组对过碳酸钠产生了浓厚的兴趣,决定对其进行探究。
【查阅资料】
Ⅰ.过碳酸钠在水中易离解成Na 2CO 3和H 2O 2,其水溶液具有Na 2CO 3和H 2O 2的双重性质;
Ⅱ.过碳酸钠与盐酸反应:2(2Na 2CO 3•3H 2O 2)+8HCl═8NaCl+4CO 2↑+3O 2↑+10H 2O;
Ⅲ.过碳酸钠的去污能力主要与其在反应中释放处的"活性氧"有关,"活性氧"含量越高,去污能力越强。
(1)20℃时,测得1%过碳酸钠水溶液的pH为10.5,说明其溶液呈 (选填"酸性"、"中性"或"碱性")。
(2)向过碳酸钠水溶液中加入少量MnO 2时产生大量气泡,发生反应的化学方程式是 。
(3)过碳酸钠样品中"活性氧"含量可按如下公式计算:
"活性氧"含量=  ×100%
×100%
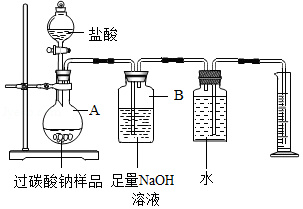
为测定某过碳酸钠样品中"活性氧"含量,取20g样品按如图实验装置与足量盐酸反应。(已知样品中杂质不溶于水且不与盐酸反应,装置气密性良好)
①将盐酸慢慢地入A中,反应一段时间,观察到 ,停止滴加盐酸。
②装置B可吸收生成的CO 2,该反应的化学方程式是 。
③甲同学认为若要得出生成氧气的质量,除要记录量筒内液体的读数外,还需要知道的数据是该实验条件下的 。
④将反应后A中所得溶液过滤、蒸发、结晶、烘干,称得固体质量为11.7g,乙同学据此计算出该过碳酸钠样品的"活性氧"含量,写出其计算过程。
⑤完成上述探究后,丙同学提出:称量反应前后装置B的质量,其质量差就是反应生成CO 2的质量,据此可计算出样品中"活性氧"含量。但丁同学认为该方案不合理,丁同学的理由是 (填写一条即可)
课外活动小组为测定某未知稀硫酸的质量分数,进行了下面实验:
①取10g稀硫酸于烧杯中,逐滴滴加BaCl2溶液,至不再产生白色沉淀止,经过滤、洗涤,干燥后,称得沉淀物的质量为4.71g
②为保障测定结果的精确性,按实验①操作又连续进行了四次相同的实验。几次实验所得数据见下表:
第一次 |
第二次 |
第三次 |
第四次 |
第五次 |
|
固体质量/g |
4.71 |
4.63 |
4.64 |
4.66 |
4.66 |
分析实验与表中数据后,回答:
(1)第一次实验测得数据明显偏高,可能的原因是 ;
(2)五次测定结果的平均值是 ;
(3)请利用(2)中数据计算:未知稀硫酸的质量分数是 。(不要求计算过程,计算结果精确到0.01)
某学校兴趣小组在参与"五水共治"行动中,考察了某工厂的废水处理工程,并取该厂未经处理的废水样品进行测定分析:
(1)用紫色石蕊试液检验废水的酸碱性,石蕊试液呈 色,说明该废水显酸性.
(2)另取废水样品少量,滴加适量Ba(NO 3) 2,有白色沉淀产生,说明该废水中一定含有的酸根离子是 .
(3)同学们进一步了解到该废水中中含有一种酸,为测定其所含酸的质量分数,取该废水200克于烧杯中,逐渐加入硝酸钡溶液,生成的沉淀质量与加入硝酸钡溶液的质量关系如图所示,请计算废水中硫酸的质量分数.(假设该废水中的其他物质均溶于水且不与硝酸钡溶液反应).

在校园科技节上,为测出鸡蛋壳(主要成分是碳酸钙)中钙元素的质量分数,某同学称取已洗净、晾干、研成粉末的鸡蛋壳10克置于烧杯中,将烧杯放在电子天平上,往烧杯中加入足量的稀盐酸,每0.5分钟记录一次电子天平的示数,据此计算出产生气体的质量,具体数据如表(反应的化学方程式为CaCO3+2HCl═CaCl2+H2O+CO2↑)
时间(分钟) |
0 |
0.5 |
1.0 |
1.5 |
2.0 |
2.5 |
3.0 |
产生气体质量(克) |
0 |
1.80 |
3.00 |
3.60 |
3.96 |
3.96 |
3.96 |
(1)若产生的气体全部是鸡蛋壳中的碳酸钙与盐酸反应生成的CO2,根据实验结果计算出该鸡蛋壳中钙元素的质量分数。(假定鸡蛋壳中其它成分不含钙元素,写出具体计算过程)
(2)下列哪些情况会导致实验中钙元素质量分数测量结果偏大? (可多选)
A.盐酸溶质质量分数过大 B.鸡蛋壳未晾干 C.鸡蛋壳中含有碳酸镁 D.鸡蛋壳未充分研碎。
电解法是工业上制铜的主要方法:控制一定条件,电解硫酸铜溶液,析出的铜附着在阴极板上,化学方程式为:2CuSO 4+2H 2O  2Cu↓+O 2↑+2H 2SO 4.取一定质量的硫酸铜溶液,在实验室中模拟工业条件进行电解,当硫酸铜恰好完全反应时,得到488.0g溶液和9.6gCu.(注:本题不考虑气体在溶液中的溶解)
2Cu↓+O 2↑+2H 2SO 4.取一定质量的硫酸铜溶液,在实验室中模拟工业条件进行电解,当硫酸铜恰好完全反应时,得到488.0g溶液和9.6gCu.(注:本题不考虑气体在溶液中的溶解)
回答下列问题:
(1)原硫酸铜溶液中溶质的质量分数是多少?(写出解题过程)
(2)向电解后得到的488.0g溶液中加入一定量的某种物质,充分反应后,所得溶液的质量、溶质质量分数均与原硫酸铜溶液相同。则这种物质可能是下列物质中的 (填选项编号)
A.Cu B.CuO C.Cu(OH) 2D.CuCO 3
用光卤石为原料提取的氯化钾产品中含有氯化镁杂质,产品等级中氯化钾指标为:
指标名称 |
优良品 |
一级品 |
二级品 |
氯化钾质量分数(≥) |
93.00% |
90.00% |
87.00% |
为确定某氯化钾产品等级进行了以下实验:
步骤一(溶解):取40.0g氯化钾产品溶于水,配制成溶液。
步骤二(沉淀):向步骤一所得溶液中加入过量的质量分数为10%的氢氧化钾溶液112.0g,充分反应后过滤,得2.9g沉淀和一定质量的滤液。
步骤三(回收):向步骤二所得滤液中加入盐酸至溶液呈中性,得到400.0g溶液,将所得溶液蒸发结晶,回收氯化钾固体。
回答下列问题:(提示:KCl溶液呈中性;不考虑实验过程中的损失)
(1)通过计算判断该产品的等级。(写出解题过程)
(2)步骤三所得溶液中氯化钾的质量分数为 。
CO2是最主要的温室气体,也是巨大的碳资源,CO2的低能耗捕集、转化和利用正受到世界各国的广泛关注。
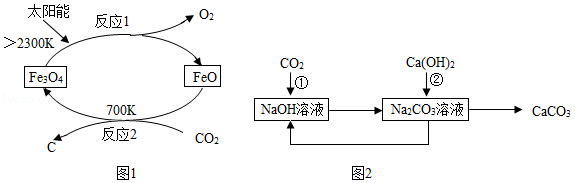
(1)以CO2为原料制取炭黑的太阳能工艺如图1所示。
①反应1的基本类型为 。
②反应2中碳元素的化合价 (填“升高”“不变”或“降低”)。
(2)利用NaOH溶液吸收CO2,部分转化关系见图2。
反应①的化学方程式为 ,该转化中循环使用的物质是 。
(3)利用Na2CO3或K2CO3溶液吸收低浓度的CO2,将其转化为NaHCO3或KHCO3,NaHCO3或KHCO3受热分解生成高浓度的CO2储存利用,生成的Na2CO3或K2CO3循环使用以降低生产成本。
吸收剂 |
Na2CO3 |
K2CO3 |
20℃最高浓度(g/L) |
212 |
1104 |
价格(元/Kg) |
1.25 |
9.80 |
根据表中信息,选择K2CO3溶液作吸收液的优点是 。
(4)利用一种新型“人造树叶”将CO2转化为乙醇(C2H5OH)的反应如下:2CO2+3H2O C2H5OH+3O2,研究显示,1L“人造树叶”每天能从空气中吸收968g CO2,计算1L“人造树叶”工作1天可得到乙醇的质量(写出计算过程)。
(5)某研究小组设计如图3所示实验,探究CO2和H2在一定条件下反应的产物。
查阅资料:①CO2和H2在合适催化剂和一定温度下反应转化为CO和H2O;
②白色无水硫酸铜吸水后变为蓝色。
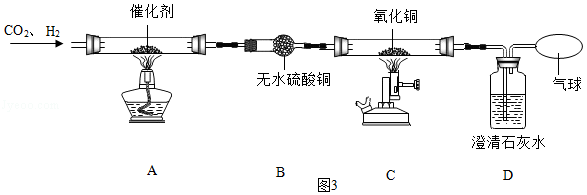
实验过程中观察到的主要现象有:B装置中白色固体变为蓝色,C装置中黑色固体变为红色,D装置中澄清石灰水变浑浊。
①设计B装置的目的是 。
②C装置中发生的反应的化学方程式为 。
③研究小组反思后认为,根据上述实验现象不能确认CO2和H2反应生成了CO,理由是 。
镁元素广泛应用于火箭、导弹和飞机制造业,被称为“国防元素”。如图1所示为制取单质镁的转化过程,试回答下列问题:
如图转化过程中发生的化学反应主要有:

MgCl2+Ca(OH)2═Mg(OH)2↓+CaCl2
Mg(OH)2+2HCl═MgCl2+2H2O,MgCl2 Mg+Cl2↑
(1)在过程①中,所加石灰乳的主要成分是 (填写化学式)。
(2)过程②所发生的反应属于 (填“化合”“分解”“置换”或“复分解”)反应。
(3)下列有关过程③中能量转化的说法,正确的是 (填选项序号)。
A.电能转化为化学能 B.化学能转化为电能 C.潮汐能转化为化学能
(4)海水或卤水中本来就含有氯化镁,还需要过程①②的原因是 (选项序号)。
A.将氯化镁富集提纯 B.生成更多氯化镁 C.使石灰乳和稀盐酸反应
(5)某化学兴趣小组欲测定某氯化镁样品中MgCl2的含量(杂质为NaCl),称取10g该样品将其置于干净的烧杯中,加入适量水,使固体样品完全溶解。向所得溶液中逐滴加入溶质质量分数为10%的NaOH溶液,生成沉淀的质量与滴入NaOH溶液的质量关系如图所示。试回答下列问题:

①当滴入NaOH溶液120g时(即图中B点),烧杯中溶液里含有的溶质为 (写化学式)。
②当滴入10%的NaOH溶液80g时(即图中A点),恰好完全反应,试通过计算,求10g此氯化镁样品中MgCl2的质量。(计算结果精确至0.1g)
绍兴市获得2015年度全省“五水共治”工作优秀市并被授予大禹鼎,“五水共治”是指治污水、防洪水、排涝水、保供水、抓节水,还社会一个蓝天碧水,为百姓创造美好的生活环境。
某化工厂流程会产生澄清废水,其中可能含有的离子是Ag+、Cu2+、Cl﹣、NO3﹣,已知:白色的沉淀Fe(OH)2在空气中会迅速转化为红褐色的Fe(OH)3。
(1)取少量废水,加入过量稀盐酸,产生白色沉淀;再加入过量氢氧化钠溶液,产生蓝色沉淀。该废水中含有的金属离子是 。
(2)兴趣小组设计了一个除去该废水中原有金属离子的实验方案,部分流程如图所示。操作I的名称是 ,单质A是 。

某工厂废液中含有CuSO 4(其他成分不含铜元素),现按以下流程回收金属铜.

(1)回收过程中,加入适量稀硫酸可除去过量铁屑,该反应的化学方程是为Fe+H 2SO 4═FeSO 4+H 2↑,这个反应所属的基本反应类型是 .
(2)洗涤后的滤渣不能用加热的方法干燥,其原因是 .
(3)现有一批废液,其中含4吨CuSO 4,理论上可从该废液中回收得到多少吨金属铜?
硼及其化合物在现代工农业、医学、国防中有着重要的应用价值。利用硼镁矿可制备硼,工艺流程如图所示。请回答下列问题:

(1)B2O3中B元素的化合价为 。
(2)为加快硼镁矿石与浓NaOH溶液的反应速率,可采取的措施是 ;回收副产物Mg(OH)2可制得流程 的反应物。
(3)H3BO3加热分解只生成两种氧化物,流程②的化学反应方程式为 。
(4)根据流程③的化学反应方程式:B2O3+3Mg 2B+3MgO,理论上制备1.1吨的硼,需消耗镁多少吨写出计算过程)?
如图1是某品牌化肥标签,为了验证该化肥的含氮量,分析和实验如下:
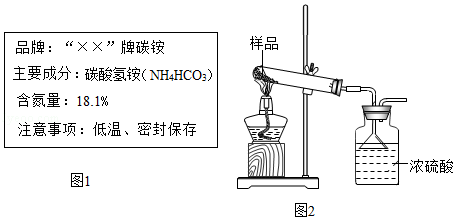
(1)通过列式计算判断此标签是否有错误。(计算结果保留至0.1%)
(2)根据国家标准碳铵化肥中碳酸氢铵含量不得低于95%.某实验小组为了验证该化肥是否合格,利用图2装置进行了三次试验(假设杂质不发生反应),实验结果如下:
实验次数 |
1 |
2 |
3 |
平均值 |
样品的质量/g |
16.0 |
16.0 |
16.0 |
16.0 |
浓硫酸增加的质量/g |
3.41 |
3.39 |
3.40 |
3.40 |
①小华同学认为反应后浓硫酸增加的质量是氨气的质量,反应为2NH3+H2SO4═(NH4)2SO4.根据小华的分析,该化肥中碳酸氢铵的质量分数为 (计算结果保留至0.1%)。
②小青同学认为小华的计算结果不能说明该化肥是否合格,理由是 。根据小青的分析,列式计算该化肥中碳酸氢铵的质量分数,并判断该化肥是否合格。(计算结果保留至0.1%)
活性碳酸钙(CaCO3)和炭黑(C)常用作橡胶的填充料,用来改良橡胶性能.在不同的橡胶制品中,对活性碳酸钙和炭黑的投料比有不同的要求.现有一份由活性碳酸钙和炭黑组成的橡胶填充料样品,为测定其中活性碳酸钙的含量,小科用如图所示的实验装置进行实验

实验步骤如下:
①按图连接装置并检查装置的气密性;
②取样品4.0g,置于甲中的硬质玻璃管内,乙中加入足量的氢氧化钠溶液;
③通入干燥的氧气一段时间后,电子称的示数稳定在150.0g;
④继续保持氧气通入,点燃酒精喷灯,加强热;
⑤充分反应后(C被完全氧化,CaCO3被完全分解),最终电子称的示数稳定在152.2g;
⑥实验结束后,根据实验所得的数据进行计算.
请回答下列问题:
(1)实验中所用的氧气可以在实验室中利用 分解得到.
(2)步骤③中先通入干燥的氧气一段时间的目的是 .
(3)计算样品中活性CaCO3的质量分数(结果精确到0.1%).
我国著名化工专家侯德榜创立了"候氏制碱法",促进了我国民族工业的发展。其生产原理是在氯化钠饱和溶液中通入氨气,再通入二氧化碳,使溶解度较小的碳酸氢钠从溶液中以沉淀的形式析出:
NaCl+NH 3+CO 2+H 2O═NH 4Cl+NaHCO 3↓
过滤出碳酸钠晶体,再受热分解得到产品:2NaHCO 3  Na 2CO 3+H 2O+CO 2↑
Na 2CO 3+H 2O+CO 2↑
(1)"侯氏制碱法"制得的"碱"是 (写化学式);
(2)根据化学方程式计算,5.85吨NaCl可制得8.4吨NaHCO 3,实际上从反应后的混合物溶液中析出NaHCO 3晶体的质量 8.4吨;(选填"大于"、"等于"或"小于")
(3)与"侯氏制碱法"不同的是,比利时科学家苏尔维在制碱过程中,向滤出NaHCO 3晶体后的混合溶液中加熟石灰以回收氨气:2NH 4Cl+Ca(OH) 2  CaCl 2+2NH 3↑+2H 2O
CaCl 2+2NH 3↑+2H 2O
请计算:NH 4Cl质量分数为20%的混合溶液5.35吨,完全反应后理论上可获得NH 3多少吨?
试题篮
()