向盛有10g纯碱样品(含有少量氯化钠)的烧杯中加入稀盐酸。加入80g稀盐酸时,恰好完全反应。反应后烧杯内物质总质量为86.7g。
(1)该反应生成二氧化碳的质量为 g;
(2)求该纯碱样品中碳酸钠质量分数(写出计算过程)。
某小组在学习"二氧化碳与氢氧化钠溶液反应"时,进行了如下探究,
【提出问题】二氧化碳与氢氧化钠反应,还是溶解在水中?
【查阅资料】
①15℃、101KPa时,二氧化碳的溶解度如下:
| 溶剂 |
水 |
酒精 |
| 溶解度 |
1.0 |
0.3 |
②15℃时,在酒精中氢氧化钠易溶、碳酸钠微溶。
③通常情况下,稀溶液的体积约等于溶剂的体积。
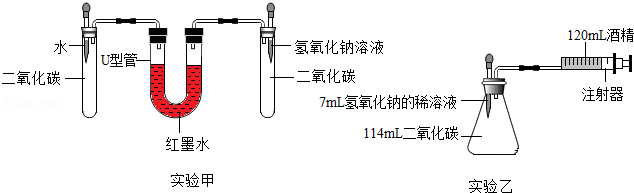
【实验设计】在15℃、101KPa时,制取二氧化碳并用于实验甲、实验乙。
【分析与表达】
(1)如果二氧化碳与氢氧化钠反应,化学方程式是 ,那么氢氧化钠应 保存。
(2)实验前,两套装置都进行气密性检查,实验甲装置气密性检查的方法是
(3)实验甲中,同时滴入等体积的水和氢氧化钠溶液后的现象是
(4)实验乙中,将氢氧化钠完全滴入锥形瓶中,注射器会自动向内移动并将酒精推入锥形瓶,活塞的移动速度是 。(填答案字母)
A.先慢后快 B.先快后慢 C.先慢后快,再变慢
实验乙中,还可能观察到的现象是 。
(5)实验乙中,120mL酒精 (填"能"或"不能")换成水,原因是 。
(6)实验乙结束时,注射器中酒精体积为20mL,则与氢氧化钠反应的二氧化碳体积至少是 mL。
(7)由以上探究可知,二氧化碳能溶于水,也能氢氧化钠反应,但实验乙的数据还不够准确,造成实验乙误差的原因可能有 。(写一条)
有一包白色粉末,可能含氯化钠、氢氧化钠、碳酸钠中的一种或几种,为了确定其组成,小明称取了9.3克粉末,向其中加入100克7.3%的稀盐酸充分反应,生成的二氧化碳气体完全逸出(忽略其他物质逸出),所得溶液的质量为107.1 克。用pH试纸检测溶液呈中性。
(1)产生二氧化碳气体的化学反应方程式为 。
(2)这包白色粉末的成分为 。
(3)求所得溶液中溶质的质量分数。(写出计算过程,结果保留一位小数)
中国医学著作博大精深,许多化学物质很早就出现在了我国医书中。如李时珍的《本草纲目》中就有绿矾(FeSO4•7H2O)的相关记载。绿矾又名皂矾、青矾,性酸、凉、无毒,主要药用功能是除湿、解毒、收敛、止血。
(1)请写出铁与稀硫酸反应的方程式 。
(2)某实验小组欲用久置的硫酸亚铁溶液制备绿矾(FeSO4•7H2O)晶体,小明同学提出该硫酸亚铁溶液可能变质了,于是进行了以下探究活动:
[查阅资料]
①FeSO4易被空气中的氧气氧化成Fe2(SO4)3而变质。
②Fe2+在溶液中呈浅绿色,Fe3+在溶液中呈黄色。
③Fe3+的检验:向含Fe3+的溶液中滴加无色的KSCN(硫氰化钾)溶液,溶液会变为血红色。
[猜想与假设]猜想1:该硫酸亚铁溶液没有变质。
猜想Ⅱ:该硫酸亚铁溶液已经变质。
[设计实验并验证]
实验操作步骤 |
实验现象 |
实验结论 |
取少量样品于试管中,加入2﹣3滴 溶液 |
试管中溶液变成血红色 |
|
[实验拓展1]下列各组物质在溶液中能大量共存,且形成无色溶液的是 。
A.CuSO4、NH4Cl、Ba(OH)2
B.FeSO4、Na2SO4、KCl
C.FeCl3、NaOH、HCl
D.NaCl、MgSO4、KNO3
[实验拓展2]该实验小组继续查阅资料得知,单质铁能与硫酸铁溶液反应生成硫酸亚铁。于是向上述久置的硫酸亚铁溶液中加入过量铁粉,写出其中的化学方程式 。
巴中某超市卖的纯碱(Na2CO3)产品往往含有少量的氯化钠(NaCl),化学兴趣小组的同学通过实验来测定该纯碱样品中纯碱的质量分数.他们取12g纯碱样品放入烧杯中,逐滴加入稀盐酸至不再产生气泡为止,共消耗盐酸100g,烧杯中没有残留不溶物,称得反应后溶液的质量为107.6g.计算:
(1)生成二氧化碳 g.
(2)样品中纯碱的质量分数是多少?(要求写出计算过程,结果精确到0.1%)
镁在国产大飞机C﹣919”的制造中大显身手,小亮在实验室模拟“海水制镁”的原理来富集镁,他将25g氯化钠和氯化镁的固体混合物全部溶解于盛有70g水的烧杯中,然后向其中加入63.6g氢氧化钠溶液至恰好完全反应(图象如图),过滤,称量滤液质量为147g,求:
(1)图象中m= g。
(2)滤液中溶质的质量分数是多少?

造纸是我国古代四大发明之一,它极大地推动了人类文明的发展。
(1)践行“习近平生态文明思想”,应积极推广垃圾分类和回收利用。旧报纸应投放到贴有如图 (填字母)标签的垃圾筒内。

6105n,n为正整数]中H、O两种元素的质量比为 (用最简整数比表示)。
(3)造纸会产生大量含NaOH的废水,需处理至中性后排放。环保监测小组取某造纸厂废水样品过滤,为测定滤液中NaOH的质量分数,进行了如下实验:
步骤1:取20.0g滤液于锥形瓶中,滴入几滴酚酞溶液。
步骤2:向锥形瓶中逐滴滴加溶质质量分数为10.0%的硫酸溶液至溶液呈中性,此时溶液呈 色。消耗硫酸溶液3.92g。
计算废水滤液中NaOH的质量分数。(请写出计算过程)
某氢氧化钠样品中混有氯化钠,为测定样品中氢氧化钠的质量分数,称取5g样品,加入27g水完全溶解后,缓慢加入稀盐酸,同时测定溶液的pH=7时,刚好用去10%的稀盐酸36.5g,试计算:
(1)将100g质量分数为38%的浓盐酸稀释成10%的稀盐酸,需加水的质量为 g。
(2)样品中氢氧化钠的质量分数。
(3)反应后所得溶液中溶质的质量分数。
水是由氢、氧两种元素组成的化合物。这一结论是科学家们在大量实险的基础上得出的。
(1)实验室中常用锌粒和稀硫酸反应来制备氢气。请从图1装置中选择并组装一套制取干燥氢气的装置,正确的连接顺序为 (用接口处字母填写)。

(2)研究氢气的燃烧实验是人们认识水组成的开始。
①氢气在点燃前一定要 。
②氢气在空气中燃烧时,若在火焰上方罩一冷而干燥的小烧杯,可观察到的现象是 。在相同条件下,欲使1L氢气完全燃烧,所需空气至少约为 L。
(3)科学家们又用“电解法”证明了水的组成(装置如图2所示,电极不与水及生成的气体反应)。电解时,水中需加入少量的NaOH,其作用是 。 通电一段时间后,发现甲、乙两量筒中收集的气体体积比略小于1:2,其原因可能是 (写出一条即可)。
(4)拉瓦锡还用另一实验证明了水的组成。
他让水蒸气通过一根烧红的铁质枪管,结果得到了氢气,同时枪管表面有黑色固体(磁铁矿的主要成分)生成。该反应的化学方程式为 。
(5)用“氢气还原氧化铜”实验也可以证明水的组成(图3)。装置A中的玻璃管和其中物质在反应前后的质量差为m1,装置B和其中物质在反应前后的质量差为m2,据此可计算出水中O、H元素的质量比为 (用含 m1、m2的代数式表示)。实验时该比值往往略小于8:1,原因可能是 (写出一条即可)。
(6)碘与锌在常温下反应速度很慢,若滴入几滴水则反应剧烈,水在此的作用是 。
对销售的化肥,国家有明确的质量要求。某兴趣小组对市售的某钾肥进行了检测,称取2.0g样品放入烧杯中,加入适量的水溶解后,逐滴加入10%的BaCl2溶液,产生沉淀的质量与所加入BaCl2溶液质量的关系如图1所示(假定杂质不参加反应)。
已知:K2SO4+BaCl2═BaSO4↓+2KC1。

(1)20.8g BaCl2溶液中所含溶质的质量为 g。
(2)通过计算,判断该钾肥中K2SO4的质量分数是否符合图2的包装说明?(写出计算过程)
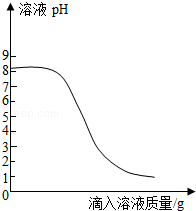
某化学兴趣小组对胃药"碳酸氢钠片"进行了探究,具体做法如下:
Ⅰ.取1片胃药研碎,加水完全溶解得到100g溶液;
Ⅱ.配制100g 0.365%的稀盐酸作为模拟胃酸;
Ⅲ.取上述一种溶液20g于锥形瓶中,再将另一种溶液逐滴加入锥形瓶内,反应后溶液的pH变化情况如图所示。
请回答下列问题:
(1)碳酸氢钠属于 (填"酸""碱"或"盐");
(2)步骤Ⅲ中,当滴入另一种溶液的质量为10g时,锥形瓶内物质恰好完全反应(胃药中其它成分不参加反应),请根据实验数据计算每片胃药中碳酸氢钠的质量,写出必要的计算过程。
实验室用含杂质的锌与稀硫酸反应制取氢气,取8g含杂质的锌粒于烧杯中(所含杂质不溶于水,也不与酸反应),向其中加入74.2g稀硫酸,恰好完全反应后烧杯内剩余物质的质量为82g。计算:
(1)杂质的质量 g。
(2)反应后所得溶液的溶质质量分数(请写出计算过程)
阅读下列材料,回答问题:
材料一:研究人员发现大气层中特别是南极上空的臭氧层日益变薄。进入大气平流层的氯氟烃(一类合成有机化合物,应用于冰箱和空调的制冷剂、灭火器等)是造成臭氧层变薄的主要原因。因为在紫外线的照射下,平流层中的臭氧存在如下平衡:O 3 O 2+O;而氯氟烃进入平流层后会分解产生氯原子(Cl),进而发生下列反应:Cl+O 3→ClO+O 2;ClO+O→Cl+O 2
研究表明:平流层中1个氯原子大约可以破坏1×10 5个臭氧分子。氯氟烃分解产生的氯原子在上述反应中起着 作用。
试题篮
()