小丽和小科在做“金属与酸反应”的实验时,他们分别将镁条投入盛有稀盐酸的试管中,小丽加入少量镁条,而小科加入了足量镁条。一段时间后,小科的试管底部“意外”地出现了灰白色固体。为探究该固体是什么物质,他们开展了如下探究:
【提出问题】足量镁和稀盐酸反应生成的灰白色固体是什么?
【查阅资料】氢氧化镁和碱式氯化镁[ ]都难溶于水,但都能与稀硝酸反应,后者能生成 和 。
【建立假设】假设1:未溶解完的氯化镁;假设2:氢氧化镁;假设3:碱式氯化镁;……
【进行实验】将灰白色固体过滤、充分洗涤后进行如下实验:
|
序号 |
实验操作 |
实验现象 |
实验结论 |
|
实验一 |
取灰白色固体于试管中,加入足量蒸馏水,充分振荡 |
固体不溶解 |
假设1 |
|
实验二 |
取灰白色固体于试管中,加入足量稀硝酸,充分振荡 |
固体溶解 |
假设2不成立 |
|
往上述溶液中滴加硝酸银溶液 |
|
【评价交流】小丽认为该灰白色固体一定是碱式氯化镁。小科认为上述探究还不足以说明该固体就是碱式氯化镁,其理由是 。
【继续探究】……
一辆载满20t电石的挂车,在浙江滨江区燃起熊熊大火并伴有大量黑烟。事故路面上洒落了五六百米燃着的石头。这辆货车在雨中整整燃烧了一天,消防官兵对大火也束手无措,场面让人震撼。大家对电石的化学性质产生了浓厚的兴趣,请你一起与他们完成下列探究活动.
【查阅资料】电石的主要成分是碳化钙(CaC2),可以与水反应生成一种可燃性气体及白色固体。常见的可燃性气体中,乙炔(C2H2)燃烧时伴有大量黑烟。
【猜想与假设】
电石与水反应生成的可燃性气体是:氧气、氢气或乙炔(C2H2);同学们做出以上猜想的依据是 ,大家讨论后,一致认为该气体不可能是氧气,原因是 。电石与水反应生成的白色固体是:氧化钙、氢氧化钙或碳酸钙中的一种。同学们经过讨论认为白色固体不可能是氧化钙,因为氧化钙会与水反应。
【实验探究】
| 实验步骤 |
实验现象 |
实验结论 |
| (1)取适量电石加水反应,收集生成的气体,验纯后点燃. |
气体燃烧,产生黄色火焰并伴有浓烈黑烟. |
电石与水反应产生的气体是 |
| (2)取适量反应后生成的固体于试管中,滴加过量稀盐酸. |
固体溶解, |
电石与水反应产生的固体不是碳酸钙 |
| (3)取适量反应后生成的固体于试管中加水,向上层清液中滴加 . |
溶液变红 |
电石与水反应产生的固体是氢氧化钙 |
【反思交流】请根据以上实验结论写出电石与水的反应的化学方程式 ;
载有电石货车可以在雨中整整燃烧一天而不熄灭,说明电石与水反应是 (填“吸热”或“放热”)反应。
兴趣小组同学为了探究实验室中久置的氢氧化钠固体的成分,进行了有关实验。请你与他们一起完成以下探究活动:
【查阅资料】Na2CO3溶液呈碱性。
【对固体猜想】
猜想Ⅰ.全部是NaOH;
猜想Ⅱ.全部是Na2CO3。
猜想Ⅲ.是NaOH和Na2CO3的混合物。
【实验和推断】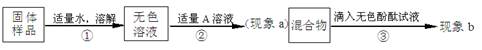
(1)若现象a为有气泡产生,则加入的A溶液是 ,说明氢氧化钠 (填“已经”或“没有”)变质。
(2)若A是CaCl2溶液。①现象a有白色沉淀产生,现象b无色酚酞不变红色,则猜想 成立。②猜想Ⅲ成立的实验现象是 。
某研究性学习小组欲利用下列装置进行相关气体制取的探究,请你分析并填空。
(1)写出图中仪器a、b的名称:a:________,b:________
(2)实验室制取氢气的化学方程式是_______________________,若用排空气法收集氢气,应选择的收集装置是__________.B装置中的长颈漏斗末端位于液面下的原因是___________________.
(3)实验室采用加热氯酸钾和二氧化锰的固体混合物制取氧气,反应化学方程式是______________________.将装置A和C连接进行此实验,实验结束,停止加热前要先将导管移出水面,目的是__________________.若用盛满水的F装置收集氧气,应从导管________(填①或②)通入。
(4)甲烷(CH4)是一种无色、无味、难溶于水的气体,实验室用加热无水醋酸钠和碱石灰的固体混合物的方法制取甲烷,应选择的发生装置是________.
(5)实验室制备CO2应选择的发生装置为________,若是用D收集CO2检验是否收集满的方法为_________________.
学习复分解反应后,某化学兴趣小组的同学对初中化学常见的四种物质稀盐酸、 粉末、 溶液、 溶液之间的反应进行如图所示的实验探究。

(1)大家一致认为试管①中不发生复分解反应,理由是 。
(2)试管②中观察到的现象是 。试管③中发生反应的化学方程式为 。
(3)将试管③反应后的物质过滤,对滤液中溶质的成分进一步探究:
【提出问题】滤液中溶质的成分是什么?
【猜想假设】猜想一:
猜想二: 、
猜想三:
【设计实验】
|
实验操作 |
实验现象 |
结论 |
|
步骤一:取少量滤液于试管中,加入适量 溶液 |
无明显现象 |
猜想 不成立 |
|
步骤二:取少量滤液于试管中,加入适量稀硫酸 |
有白色沉淀生成 |
猜想三成立 |
【反思拓展】
Ⅰ.探究反应后溶液中溶质的成分,既要考虑生成物,又要考虑反应物是否有剩余。
Ⅱ.依据复分解反应发生的条件,步骤二中除可用稀硫酸外,还可选用 (填字母序号)也能达到同样的实验目的。
a.稀盐酸
b.氢氧化钠溶液
c.碳酸钠溶液
如图一是某食品标签,小颖看到食品添加剂中有"碳酸氢铵",感觉很惊讶,"碳酸氢铵"是臭粉啊,怎么可以放进食品?于是开展了以下探究,请你帮助完成下列相关问题。
(1)分析食品成分:营养物质:配料中含有多种营养物质,其中富含糖类的有 ;
食品添加剂:主要是盐类,酸类等物质。
(2)查阅资料:①食用级碳酸氢铵比较纯净,可作膨松剂,一般用在油炸食品中,水蒸食品中不用;
②常温常压下,1体积水约能溶解600体积氨气,其水溶液呈弱碱性。
(3)产生疑惑:臭粉为何可以作膨松剂?为何一般适用于油炸食品而不适用于水蒸食品?
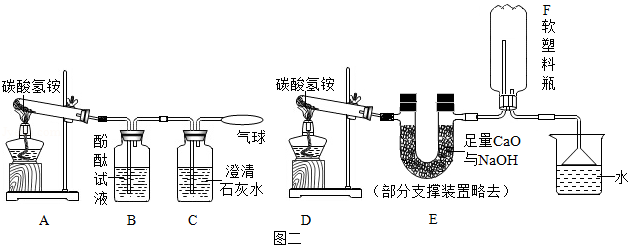
(4)实验设计:实验装置如图,图二是检验装置,图三是收集装置,取适量碳酸氢铵分别置于两试管中,按如图进行实验。
(5)现象与分析:①图二:反应过程中的现象是 ,C中澄清石灰水变浑浊,当B中不再有气泡冒出时,A装置试管中固体消失、 。
②图三:装置E的作用是 ,F中收集到氨气,说明氨气具有 性质,取下F,塞上橡皮塞,用注射器向F中注入少量水,看到的现象是 ,拔出橡皮塞闻到氨味。
(6)解释与结论:①有臭味的碳酸氢铵添加到食品中,如果油炸,则含有的少量碳酸氢铵受热时完全分解,产生的气体使食品膨胀,且生成物可以迅速挥发而离开食品,没有残留物,其臭味会消失,碳酸氢铵发生反应的化学方程式是
②添加碳酸氢铵的食品如果水蒸,则 。
通过上述探究小颖明白了:高纯度的碳酸氢铵可以作为食品添加剂,但同一食品添加剂并不适合所有食品,使用食品添加剂需严格控制用量。

【2015年江苏省盐城市】实验室中有一瓶长期使用的氢氧化钠固体样品,某兴趣小组的同学对该样品的成分及含量进行探究.
【发现问题】该样品中含有哪些物质?
【查阅资料】①NaOH在空气中不会转化成NaHCO3.
②BaCl2溶液呈中性,Ba(OH)2是可溶性碱
③CO2在饱和的NaHCO3溶液中几乎不溶解
【提出猜想】猜想Ⅰ:NaOH 猜想Ⅱ:Na2CO3 猜想Ⅲ:NaOH和Na2CO3
【设计实验】
| 实验操作 |
实验现象 |
 |
步骤①:样品全部溶解 步骤②:观察到现象A |
【收集证据】(1)若现象A是有气泡产生,则X溶液为 ,则 (填“猜想Ⅰ”、“猜想Ⅱ”或“猜想Ⅲ”)不成立.
(2)若X溶液为BaCl2溶液,现象A是有白色沉淀生成,则产生沉淀的化学方程式是 ,取反应后的上层清液,测定其PH,当PH 7(填“>”、“<”或“=”),则证明猜想Ⅲ成立.
【定量分析】确定部分变质样品中Na2CO3的质量分数.
兴趣小组的同学用如图所示装置进行实验.

步骤如下:①按图连接好装置,并检查气密性;②准确称取该样品1.0g,放入烧瓶内;③打开活塞,滴加30.0%的稀硫酸至过量,关闭活塞;④反应结束后,量筒内液体的读数为55.0mL.(已知:室温条件下,CO2的密度为1.6g•L﹣1)
(1)B装置集气瓶内原有的空气对实验结果 (填“有”或“没有”)影响.饱和NaHCO3溶液如果用水代替,则所测CO2体积 (填“偏大”、“偏小”或“不变”).
(2)计算该样品中Na2CO3的质量分数(写出计算过程,计算结果保留一位小数)
【实验反思】有同学指出,上述三种猜想并不全面,请再提出一种猜想 .
【2015年广西省玉林、防城港市】玲玲在学习复分解反应时,对复分解反应的条件产生了兴趣,于是她和小组内的同学仅用以下药品展开了探究活动。
实验药品:稀硫酸、稀盐酸、氢氧化钠溶液、碳酸钠溶液、硝酸钡溶液、氯化钠溶液、酚酞溶液
【提出问题】他们要探究的问题是 。
【查阅资料】硝酸钡溶液显中性,且Ba2+有毒。
【实验探究】玲玲用上述物质做了下列几组实验

【记录和解释】
(1)组合①、②、⑤均无明显现象,其中组合 与另外两组的实质不同。为证明该不同之处,玲玲在实验过程中使用了酚酞溶液。
(2)请写出组合③的化学方程式 。
【实验结论】他们请教老师并讨论后知道,只有当两种化合物互相交换成分,生成物中有沉淀
或 生成时,复分解反应才可以发生。
【拓展延伸】实验结束后,他们将所有废液收集在废液缸中静置,观察到白色沉淀和无色的上层清液。为了确定沉淀和清液的成分,继续展开探究。
【实验1】探究沉淀的成分。
【提出猜想】I.沉淀只有硫酸钡II.沉淀只有碳酸钡III沉淀中含有硫酸钡和碳酸钡
梅梅取少量沉淀于试管中,滴加 (请补充完整实验操作和观察到的现象),证明了猜想III是正确的。
【实验2】探究清液的成分。
①取少量清液于试管中,向其中滴加几滴硝酸钡溶液,无明显现象。
②另取少量清液于另一只试管中,滴加几滴 ,有白色沉淀产生。
【解释与结论】探究活动结束后,小组内成员通过讨论分析,一致认为清液中含有的离子是
(指示剂除外)。
【处理废液】为了防止污染环境,玲玲向废液缸中加入适量的 ,对废液进行处理后,将固体回收进一步处理,溶液排放。
【交流与反思】根据你对物质溶解性的了解,结合复分解反应发生的条件,请写出一种在水溶液中一般不能发生复分解反应的可溶性盐 (写化学式)。
实验小组在探究“酸与碱能否发生反应”时,进行了如图所示实验.请根据实验回答:
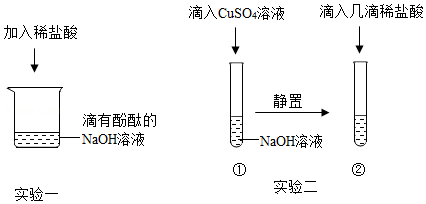
【探究实验一】酸能否与可溶性碱发生化学反应
甲同学进行了实验一,能观察到的明显现象是 ,同时测定反应后溶液的pH=2,说明酸能与可溶性碱发生化学反应.
【探究实验二】酸能否与难溶性碱发生化学反应
乙同学进行了实验二,当滴入几滴稀盐酸后,发现试管②中无明显变化,于是得出“酸不能与难溶性碱反应”的结论.
丙同学对此产生质疑,并利用实验后的物质继续探究:
【2015年贵州省黔东南州】某校化学兴趣小组对苏打(Na2CO3)和小苏打(NaHCO3)在生活中具有何作用,如何鉴别苏打和小苏打进行了如下的探究实验活动,请你参与他们的探究过程,并回答先关问题:
【查阅资料】
信息①:相同条件下,碳酸钠溶液比碳酸氢钠溶液碱性强
信息②:NaHCO3在2700C时,完全分解转化成Na2CO3,而NaHCO3不易分解
【实验过程】
(1)按有图所示进行实验,只观察到烧杯B中的石灰石变浑浊,小试管内壁出现水珠,写出小苏打分解的化学方程式 。

(2)充分利用信息知识,区分无色Na2CO3溶液
与NaHCO3溶液最简单的方用是 。
A、加热 B、pH试纸 C、稀盐酸
【实验过程】
(3)可用小苏打治疗轻度胃酸(主演含盐酸)过多的病人,其原因是:
有一包白色粉末,可能由 、 、 、 、 中的一种或几种组成,为确定其成分,某化学兴趣小组进行如下实验探究,请你参与探究并回答相关问题。
【提出问题】该白色粉末的成分是什么?
【查阅资料】
(1)部分物质在水中的溶解性表(室温):
|
物质 |
|
|
|
|
|
溶解性 |
溶 |
不溶 |
微溶 |
不溶 |
(2) 不稳定,在溶液中分解生成难溶于水的物质。
【实验探究】
|
实验步骤 |
实验现象及结果 |
实验结论 |
|
①取该白色粉末样品于烧杯,加足量水溶解。 |
样品全部溶解,得到无色溶液A |
白色粉末中不含 |
|
②取少量无色溶液A于试管,加入过量 溶液,充分反应后过滤。 |
得到无色溶液B和白色沉淀C |
白色粉末中含有 |
|
③向白色沉淀C中加入过量稀盐酸。 |
沉淀部分溶解,并有气泡冒出 |
|
|
④在无色溶液B中滴加几滴 溶液。 |
产生白色沉淀 |
白色粉末中含有 |
【交流与解释】
(1)白色沉淀C中加入过量的稀盐酸,产生气泡的反应方程式为 。
(2)在老师的指导下,通过讨论,同学们认识到由上述实验探究尚不能得出白色粉末中含有 ,理由是 。
为了进一步确定白色粉末中是否含有 ,继续进行如下探究。
【继续探究】
|
实验步骤 |
实验现象 |
实验结论 |
|
⑤另取少量无色溶液A于试管中,加入过量的 溶液,振荡,静置。 |
产生白色沉淀 |
白色粉末中含有 |
|
⑥取实验⑤所得上层清液于试管,加入 溶液。 |
产生白色沉淀 |
通过上述实验探究,确定了该白色粉末的成分。
【拓展与反思】在混合溶液中,检验某种离子时,需排除离子间的相互干扰。
【2015年江苏省泰州市】某校九(1)班同学举行“是真的吗?”化学主题活动,请你和蓓蓓一起探究。
话题1:能被磁铁吸引的物质一定是铁单质吗?
【实验验证】①将细铁丝在纯氧中完全燃烧,主要反应的化学方程式为 。
②将反应后的黑色固体用磁铁检验,能被吸引。
【实验结论】能被磁铁吸引的物质 (填“一定”或“不一定”)是铁单质。
话题2:含有Ba2+的盐一定有毒吗?
【社会调查】在医院检查胃肠疾病时,病人需服用“钡餐”(主要成分为BaSO4)。
【调查结论】“含有Ba2+的盐一定有毒”这句话是 (填“真的”或“假的”)。
【交流反思】若误服碳酸钡(BaCO3),胃酸的主要成分 (填化学式)会与之发生反应,形成可溶性钡盐,使人体内蛋白质变性而中毒,此时可服用 (填一种即可)解毒。
话题3:向某溶液中先滴加足量稀硝酸,再滴加氯化钡溶液,若产生白色沉淀,原溶液中一定含有SO42-吗?
【实验回顾】向硝酸银溶液中先滴加稀硝酸,再滴加氯化钡溶液,也产生白色沉淀,反应的化学方程式是 。
【实验结论】向某溶液中先滴加足量稀硝酸,再滴加氯化钡溶液,若产生白色沉淀,原溶液中不一定含有SO42-。
【拓展实验】向硫酸钠溶液中先滴加足量稀硝酸,再滴加氯化钡溶液,也产生白色沉淀。
【查阅资料】①硝酸具有强氧化性。向Na2SO3溶液中滴加稀硝酸时,发生如下反应:
2HNO3(稀)+3Na2SO3=3Na2SO4+2NO↑+H2O
②含有SO32-的盐统称为亚硫酸盐,亚硫酸盐都能与盐酸反应生成二氧化硫气体。
【交流反思】①向某一种钠盐溶液中先滴加足量稀硝酸,再滴加氯化钡溶液,产生白色沉淀。原溶液中阴离子可能是SO42-,还可能是 (填离子符号)。
②下列实验方案中,能证明溶液里含有SO42-的是 (填“A”或“B”)。
A.取样,先滴加氯化钡溶液,产生白色沉淀,再滴加稀盐酸,沉淀不溶解
B.取样,先滴加稀盐酸,无明显现象,再滴加氯化钡溶液,产生白色沉淀
某化学学习小组在实验室做了一次探究活动,以下是该小组填写的探究报告。
探究内容 |
探究铝分别与稀盐酸、稀硫酸的反应 |
知识应用 |
根据金属活动性顺序表,铝能与酸反应 |
实验准备 |
用同样的标准打磨大小、厚薄相同的2片铝 |
进行实验 |
室温时,向盛有等量稀盐酸、稀硫酸的2支试管中加入打磨光亮的相同的2片铝 |
现象描述 |
铝与稀盐酸反应速率很快,产生大量气泡;铝与稀硫酸反应速率一直很慢,几乎看不到气泡 |
分析猜想 |
铝分别与稀盐酸、稀硫酸分反应现象为什么相差甚远?猜想如下:①铝片表面氧化铝的影响;②铝片表面积的影响;③反应时外界温度的影响; ④硫酸铝难溶于水,阻碍了铝与稀硫酸的反应;⑤两种酸的氢离子浓度不同;⑥稀盐酸中含有的Cl﹣加快了铝和稀盐酸的反应;⑦稀硫酸中含有的SO42﹣阻碍了铝和稀硫酸的反应 |
请仔细阅读探究报告,回答下列问题
(1)猜想④不合理,理由是
(2)经过分析可以排除其影响因素的猜想有 (填序号)
(3)选择一个你认为合理的猜想并设计实验进行验证,你选择的合理猜想的序号是 ,实验设计是:室温时,将打磨光亮的相同的2片铝分别放入2支试管中,再 ,观察现象。
【2015年浙江省丽水市】在老师指导下,小科做了如下实验:点燃燃烧匙上的钠,迅速伸入盛有CO2的集气瓶中,盖上玻片,钠继续燃烧。反应结束后发现:集气瓶内壁附着黑色小颗粒,燃烧匙上粘附着灰白色固体。小科获知灰白色固体中的黑色固体成分是碳,但不清楚其中的白色固体成分是什么,于是进行了如下探究:
【提出问题】白色固体的成分是什么?
【建立假设】假设一:白色固体的成分是氧化钠;
假设二:白色固体的成分是碳酸钠;
假设三:白色固体的成分是氧化钠和碳酸钠的混合物。
【进行实验】
步骤1:取燃烧匙上灰白色固体于烧杯中,加入适量的水充分溶解,过滤,得到滤液;
步骤2:取少量步骤1中的滤液于试管中,滴加2滴酚酞试液,溶液变成红色。结论:白色固体的成分是氧化钠。有同学认为通过该实验得出的结论不正确,其理由是 。
步骤3:取少量步骤1中的滤液于试管中,滴加足量稀盐酸,溶液中有气泡冒出,结论是 。
步骤4:取少量步骤1中的滤液于试管中,加入过量的氯化钙溶液,出现白色沉淀,然后过滤,向所得滤液中滴加酚酞试液,无明显现象。则假设 成立。
【2015年甘肃省兰州市】人被蚊虫叮咬后,蚊虫在人的皮肤内分泌出蚁酸,使叮咬处又痛又痒。化学小组同学对蚁酸产生了浓厚的兴趣,决定对其进行探究。
[提出问题]蚁酸的成分是什么?它有什么性质?
[查阅资料]I.蚁酸是一种有机酸,化学名称叫做甲酸,化学式为HCOOH;
II.蚁酸在隔绝空气并加热的条件下会分解生成两种氧化物。
[实验探究]
(1)向盛有蚁酸溶液的试管中滴加紫色石蕊试液,观察到溶液颜色变成 色,说明蚁酸溶液显酸性;
(2)小芳同学根据蚁酸中含有 元素,推测出一种生成物是水;
(3)另一种生成的氧化物是气体,小敏提出两种猜想:
①猜想I:该气体是CO2;猜想II:该气体是 ;
他们将蚁酸分解产生的气体通过下图的装置。

②实验时装置A中无明显变化,则猜想I (填“成立”或“不成立”);若猜想II成立,则:
③实验时装置B的作用是 ;
④实验时装置C中的现象是 ;
⑤实验时装置D中发生反应的化学方程式为 ;
[讨论交流] 从环保角度看,该装置存在明显的缺陷,处理方法是 ;
[拓展延伸] 当你被蚊虫叮咬后,在叮咬处涂抹一些物质可减轻痛痒。下列物质中,你不会选择的物质是 。
| A.苏打水 | B.肥皂水 | C.食醋 | D.氨水 |
试题篮
()