通过观察和实验等方法获取证据是科学探究的重要环节。
(1)向少量 沉淀中加入稀盐酸,观察到______,可判断发生了反应。
(2)向 溶液中通入 ,观察到______,可判断发生了反应。
(3)向氢氧化钙溶液中滴加稀盐酸,无明显现象。两位同学欲获取反应发生的证据。
①甲同学向滴有酚酞溶液的氢氧化钙溶液中,逐滴滴加稀盐酸至足量,溶液由红色变成无色,证明溶液中______,可判断 与 发生了反应。
②乙同学将氢氧化钙溶液与稀盐酸混合,然后检验了混合液中含有 和 ,他据此认为 与 发生了反应,且生成了 。你认为乙同学是否找到了反应发生的证据?请说出你的观点并阐述理由:______。
(4)如图a所示,向 稀溶液中缓缓通入 气体,测定该过程中溶液导电能力的变化,实验结果如图b.(溶液体积、温度的变化可忽略)

①分析A→B段变化,其他条件相同,导电能力: ______ 。(填“>”“<”或“=”)
②分析B→C段变化,溶液的导电能力除了与离子种类有关,还与______有关。
已知空气的主要成分是氮气和氧气。某课外活动小组设计了测定空气中氧气含量的实验,实验装置如下图所示。
(1)红磷在集气瓶中发生反应的文字表达式为:
该实验中红磷需稍过量,目的是 。
(2)待燃烧停止,白烟消失并冷却后,打开止水夹,观察到烧杯中的水进入集气瓶,瓶内水面最终接近刻度1处。由此可知,氧气约占空气总体积的 ,由本实验还可推知氮气的哪一些性质?试写出其中的一种:
(3)若将红磷换成碳粉,该实验能否获得成功? (填“能”或“否”)
(4)人类需要洁净的空气,目前我国城市空气质量日报中的污染物主要包括
| A.一氧化碳 |
| B.二氧化碳 |
| C.二氧化硫 |
| D.可吸入颗粒物 |
E、二氧化氮
大自然的鬼斧神工造就出千沟万壑、千瀑万洞的“喀斯特地貌”,贵州双河溶洞是全球白云岩喀斯特典型的范例,某小组同学开展了研究性学习。
任务一:调查溶洞概况
小组同学通过实地勘察,绘制部分洞穴剖面图如图1。
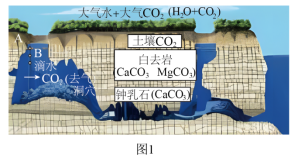
(1)溶洞岩石以白云岩为主,其中的 、 两种化合物的类别属于_____(选填“酸”“碱”或“盐”)。
(2)岩石裂缝渗水以及洞内地下水对白云岩不断侵蚀,形成千姿百态的溶洞地貌。测得A处渗水的 ,显_____性。
任务二:探究白云岩溶蚀与钟乳石的形成
【资料显示】当 遇到溶有 的水时,会生成溶解性较大的 ,发生反应① ;溶有 的水遇热或压强变小时,就会分解,重新形成 沉积下来,发生反应② 。
【探究活动1】用 模拟白云岩的溶蚀
(1)设计方案制取
白云岩中除 、 外,还含有多种成分。小组同学设计两种不同反应原理的方案制取 模拟溶蚀过程,完成下表。
|
序号 |
试剂 |
反应原理(化学方程式) |
|
方案一 |
、氢氧化钙固体、蒸馏水 |
_____ |
|
方案二 |
_____ |
_____ |
(2)进行溶蚀模拟实验
实验一:用方案一进行实验,向盛有一定量氢氧化钙固体的烧杯中加入蒸馏水,搅拌,过滤,得到饱和澄清石灰水。取 饱和澄清石灰水于烧杯中,通入一定量 ,观察到溶液立即变浑浊,继续通入过量 ,浑浊液未变澄清。
【表达交流】根据资料显示中的反应①,应观察到浑浊液变澄清,现象与预期不符。经过讨论、分析,为达到实验目的,改进实验如下。
实验二:另取 饱和澄清石灰水于烧杯中,加入 蒸馏水,搅拌,通入一定量 ,溶液逐渐变浑浊,继续通入过量 ,浑浊液变澄清。
【分析与解释】改进后现象与预期相符。加入 蒸馏水的作用是_____,浑浊液变澄清的原因是_____。
小组同学用其它的方法,证明了白云岩中的 也能在酸性条件下发生溶蚀。
【探究活动2】模拟钟乳石的形成
取实验二反应后的溶液,静置,放于低压环境,一段时间以后发现澄清溶液中出现浑浊现象,实验成功。
【迁移应用】图1中,滴水从B处下落的过程中,产生 的原因可能是_____。
任务三:模拟洞内地下水对白云岩的溶蚀
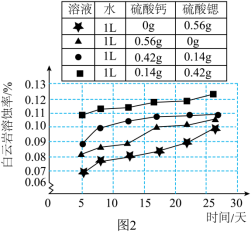
洞内地下水中富含钙离子、锶离子、硫酸根离子等,小组同学用四种盐溶液进行地下水对白云岩的溶蚀实验,测得白云岩溶蚀率(溶蚀率:白云岩减少的质量与白云岩总质量的比值。)随时间变化的关系如图2。下列说法正确的是_____(填字母序号)。
| A. |
白云岩的溶蚀率随时间的增加而增大 |
| B. |
锶离子含量越多,越能促进白云岩的溶蚀 |
| C. |
混合溶液会增大白云岩的溶蚀率 |
| D. |
白云岩的溶蚀受钙离子、锶离子的影响 |
【项目总结】沉积物是“时间胶囊”,可反映出它们形成时的地质环境,极具科研价值。
兴趣小组同学为了探究实验室中久置的氢氧化钠固体的成分,进行了有关实验。请你与他们一起完成以下探究活动:
【查阅资料】Na2CO3溶液呈碱性。
【对固体猜想】
猜想Ⅰ.全部是NaOH;
猜想Ⅱ.全部是Na2CO3。
猜想Ⅲ.是NaOH和Na2CO3的混合物。
【实验和推断】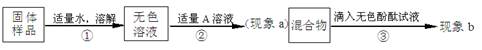
(1)若现象a为有气泡产生,则加入的A溶液是 ,说明氢氧化钠 (填“已经”或“没有”)变质。
(2)若A是CaCl2溶液。①现象a有白色沉淀产生,现象b无色酚酞不变红色,则猜想 成立。②猜想Ⅲ成立的实验现象是 。
将稀盐酸、Na2CO3溶液、Ca(OH)2溶液倒入同一烧杯中,充分反应后过滤,得到固体A和滤液B。
请回答下列下列问题。
(1)得到的固体A是________。
(2)探究滤液B中是否含有Na2CO3:取少量滤液B,滴加足量稀盐酸,始终没有气泡冒出,由此得出结论:____________________。探究滤液B中是否含有CaCl2:取少量滤液B,滴加足量Na2CO3溶液,没有沉淀出现,由此得出结论:不含有CaCl2。这一探究同时说明滤液B中也不含有Ca(OH)2。
(3)综合分析可知:滤液B中一定含有的溶质是___________。
实验小组在探究“酸与碱能否发生反应”时,进行了如图所示实验.请根据实验回答:
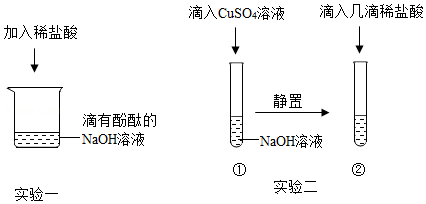
【探究实验一】酸能否与可溶性碱发生化学反应
甲同学进行了实验一,能观察到的明显现象是 ,同时测定反应后溶液的pH=2,说明酸能与可溶性碱发生化学反应.
【探究实验二】酸能否与难溶性碱发生化学反应
乙同学进行了实验二,当滴入几滴稀盐酸后,发现试管②中无明显变化,于是得出“酸不能与难溶性碱反应”的结论.
丙同学对此产生质疑,并利用实验后的物质继续探究:
【2015年贵州省黔东南州】某校化学兴趣小组对苏打(Na2CO3)和小苏打(NaHCO3)在生活中具有何作用,如何鉴别苏打和小苏打进行了如下的探究实验活动,请你参与他们的探究过程,并回答先关问题:
【查阅资料】
信息①:相同条件下,碳酸钠溶液比碳酸氢钠溶液碱性强
信息②:NaHCO3在2700C时,完全分解转化成Na2CO3,而NaHCO3不易分解
【实验过程】
(1)按有图所示进行实验,只观察到烧杯B中的石灰石变浑浊,小试管内壁出现水珠,写出小苏打分解的化学方程式 。

(2)充分利用信息知识,区分无色Na2CO3溶液
与NaHCO3溶液最简单的方用是 。
A、加热 B、pH试纸 C、稀盐酸
【实验过程】
(3)可用小苏打治疗轻度胃酸(主演含盐酸)过多的病人,其原因是:
有一包白色粉末,可能由 、 、 、 、 中的一种或几种组成,为确定其成分,某化学兴趣小组进行如下实验探究,请你参与探究并回答相关问题。
【提出问题】该白色粉末的成分是什么?
【查阅资料】
(1)部分物质在水中的溶解性表(室温):
|
物质 |
|
|
|
|
|
溶解性 |
溶 |
不溶 |
微溶 |
不溶 |
(2) 不稳定,在溶液中分解生成难溶于水的物质。
【实验探究】
|
实验步骤 |
实验现象及结果 |
实验结论 |
|
①取该白色粉末样品于烧杯,加足量水溶解。 |
样品全部溶解,得到无色溶液A |
白色粉末中不含 |
|
②取少量无色溶液A于试管,加入过量 溶液,充分反应后过滤。 |
得到无色溶液B和白色沉淀C |
白色粉末中含有 |
|
③向白色沉淀C中加入过量稀盐酸。 |
沉淀部分溶解,并有气泡冒出 |
|
|
④在无色溶液B中滴加几滴 溶液。 |
产生白色沉淀 |
白色粉末中含有 |
【交流与解释】
(1)白色沉淀C中加入过量的稀盐酸,产生气泡的反应方程式为 。
(2)在老师的指导下,通过讨论,同学们认识到由上述实验探究尚不能得出白色粉末中含有 ,理由是 。
为了进一步确定白色粉末中是否含有 ,继续进行如下探究。
【继续探究】
|
实验步骤 |
实验现象 |
实验结论 |
|
⑤另取少量无色溶液A于试管中,加入过量的 溶液,振荡,静置。 |
产生白色沉淀 |
白色粉末中含有 |
|
⑥取实验⑤所得上层清液于试管,加入 溶液。 |
产生白色沉淀 |
通过上述实验探究,确定了该白色粉末的成分。
【拓展与反思】在混合溶液中,检验某种离子时,需排除离子间的相互干扰。
【2015年江苏省泰州市】某校九(1)班同学举行“是真的吗?”化学主题活动,请你和蓓蓓一起探究。
话题1:能被磁铁吸引的物质一定是铁单质吗?
【实验验证】①将细铁丝在纯氧中完全燃烧,主要反应的化学方程式为 。
②将反应后的黑色固体用磁铁检验,能被吸引。
【实验结论】能被磁铁吸引的物质 (填“一定”或“不一定”)是铁单质。
话题2:含有Ba2+的盐一定有毒吗?
【社会调查】在医院检查胃肠疾病时,病人需服用“钡餐”(主要成分为BaSO4)。
【调查结论】“含有Ba2+的盐一定有毒”这句话是 (填“真的”或“假的”)。
【交流反思】若误服碳酸钡(BaCO3),胃酸的主要成分 (填化学式)会与之发生反应,形成可溶性钡盐,使人体内蛋白质变性而中毒,此时可服用 (填一种即可)解毒。
话题3:向某溶液中先滴加足量稀硝酸,再滴加氯化钡溶液,若产生白色沉淀,原溶液中一定含有SO42-吗?
【实验回顾】向硝酸银溶液中先滴加稀硝酸,再滴加氯化钡溶液,也产生白色沉淀,反应的化学方程式是 。
【实验结论】向某溶液中先滴加足量稀硝酸,再滴加氯化钡溶液,若产生白色沉淀,原溶液中不一定含有SO42-。
【拓展实验】向硫酸钠溶液中先滴加足量稀硝酸,再滴加氯化钡溶液,也产生白色沉淀。
【查阅资料】①硝酸具有强氧化性。向Na2SO3溶液中滴加稀硝酸时,发生如下反应:
2HNO3(稀)+3Na2SO3=3Na2SO4+2NO↑+H2O
②含有SO32-的盐统称为亚硫酸盐,亚硫酸盐都能与盐酸反应生成二氧化硫气体。
【交流反思】①向某一种钠盐溶液中先滴加足量稀硝酸,再滴加氯化钡溶液,产生白色沉淀。原溶液中阴离子可能是SO42-,还可能是 (填离子符号)。
②下列实验方案中,能证明溶液里含有SO42-的是 (填“A”或“B”)。
A.取样,先滴加氯化钡溶液,产生白色沉淀,再滴加稀盐酸,沉淀不溶解
B.取样,先滴加稀盐酸,无明显现象,再滴加氯化钡溶液,产生白色沉淀
某化学学习小组在实验室做了一次探究活动,以下是该小组填写的探究报告。
探究内容 |
探究铝分别与稀盐酸、稀硫酸的反应 |
知识应用 |
根据金属活动性顺序表,铝能与酸反应 |
实验准备 |
用同样的标准打磨大小、厚薄相同的2片铝 |
进行实验 |
室温时,向盛有等量稀盐酸、稀硫酸的2支试管中加入打磨光亮的相同的2片铝 |
现象描述 |
铝与稀盐酸反应速率很快,产生大量气泡;铝与稀硫酸反应速率一直很慢,几乎看不到气泡 |
分析猜想 |
铝分别与稀盐酸、稀硫酸分反应现象为什么相差甚远?猜想如下:①铝片表面氧化铝的影响;②铝片表面积的影响;③反应时外界温度的影响; ④硫酸铝难溶于水,阻碍了铝与稀硫酸的反应;⑤两种酸的氢离子浓度不同;⑥稀盐酸中含有的Cl﹣加快了铝和稀盐酸的反应;⑦稀硫酸中含有的SO42﹣阻碍了铝和稀硫酸的反应 |
请仔细阅读探究报告,回答下列问题
(1)猜想④不合理,理由是
(2)经过分析可以排除其影响因素的猜想有 (填序号)
(3)选择一个你认为合理的猜想并设计实验进行验证,你选择的合理猜想的序号是 ,实验设计是:室温时,将打磨光亮的相同的2片铝分别放入2支试管中,再 ,观察现象。
【2015年浙江省丽水市】在老师指导下,小科做了如下实验:点燃燃烧匙上的钠,迅速伸入盛有CO2的集气瓶中,盖上玻片,钠继续燃烧。反应结束后发现:集气瓶内壁附着黑色小颗粒,燃烧匙上粘附着灰白色固体。小科获知灰白色固体中的黑色固体成分是碳,但不清楚其中的白色固体成分是什么,于是进行了如下探究:
【提出问题】白色固体的成分是什么?
【建立假设】假设一:白色固体的成分是氧化钠;
假设二:白色固体的成分是碳酸钠;
假设三:白色固体的成分是氧化钠和碳酸钠的混合物。
【进行实验】
步骤1:取燃烧匙上灰白色固体于烧杯中,加入适量的水充分溶解,过滤,得到滤液;
步骤2:取少量步骤1中的滤液于试管中,滴加2滴酚酞试液,溶液变成红色。结论:白色固体的成分是氧化钠。有同学认为通过该实验得出的结论不正确,其理由是 。
步骤3:取少量步骤1中的滤液于试管中,滴加足量稀盐酸,溶液中有气泡冒出,结论是 。
步骤4:取少量步骤1中的滤液于试管中,加入过量的氯化钙溶液,出现白色沉淀,然后过滤,向所得滤液中滴加酚酞试液,无明显现象。则假设 成立。
【2015年甘肃省兰州市】人被蚊虫叮咬后,蚊虫在人的皮肤内分泌出蚁酸,使叮咬处又痛又痒。化学小组同学对蚁酸产生了浓厚的兴趣,决定对其进行探究。
[提出问题]蚁酸的成分是什么?它有什么性质?
[查阅资料]I.蚁酸是一种有机酸,化学名称叫做甲酸,化学式为HCOOH;
II.蚁酸在隔绝空气并加热的条件下会分解生成两种氧化物。
[实验探究]
(1)向盛有蚁酸溶液的试管中滴加紫色石蕊试液,观察到溶液颜色变成 色,说明蚁酸溶液显酸性;
(2)小芳同学根据蚁酸中含有 元素,推测出一种生成物是水;
(3)另一种生成的氧化物是气体,小敏提出两种猜想:
①猜想I:该气体是CO2;猜想II:该气体是 ;
他们将蚁酸分解产生的气体通过下图的装置。

②实验时装置A中无明显变化,则猜想I (填“成立”或“不成立”);若猜想II成立,则:
③实验时装置B的作用是 ;
④实验时装置C中的现象是 ;
⑤实验时装置D中发生反应的化学方程式为 ;
[讨论交流] 从环保角度看,该装置存在明显的缺陷,处理方法是 ;
[拓展延伸] 当你被蚊虫叮咬后,在叮咬处涂抹一些物质可减轻痛痒。下列物质中,你不会选择的物质是 。
| A.苏打水 | B.肥皂水 | C.食醋 | D.氨水 |
某化学兴趣小组对一包完全变质的生石灰干燥剂产生了好奇,为确定其成分展开如下探究:
【提出问题】这包已完全变质的干燥剂成分是什么?
【猜想】猜想I:Ca(OH) 2
猜想 II:Ca(OH) 2和 CaCO 3
猜想 III:CaCO 3
【实验探究】
(1)取少量样品于试管中,向其中滴加少量稀盐酸,无气泡产生.于是小莉认为没有CaCO 3,小晶却不同意小莉的结论,理由是 .
(2)为进一步确定其成分,小组同学共同设计了如下方案,请你完成实验报告.
| 实验步骤 |
实验现象 |
实验结论 |
| ①取少量样品于试管中,加适量水溶解,向试管中滴加几滴酚酞溶液. |
|
猜想II成立 |
| ②另取少量样品于试管中,加适量水溶 解,加 入 |
|
【实验反思】(1)步骤②中有关反应的化学方程式为 ; .
(2)生石灰变质过程可简述为:生石灰吸收 变成熟石灰,熟石灰吸收 变成碳酸钙.
【2015年黑龙江省哈尔滨市】某化学活动小组在一次实验中进行了如图所示实验:
此时观察到的实验现象是(1)___________________。
实验后,小组同学充分振荡U形玻璃管,将U形玻璃管内的物质过滤后,对滤液成分产生了浓厚的兴趣,进行了进一步的探究活动。
【提出问题】滤液中除Na+外,还含有什么离子?
【猜想与假设】A同学:含有OH-、Cl-、C032-
B同学:含有OH-、Cl-、Ba2+
C同学:含有(2)__________________(填离子符号)
【实验探究】B同学为了验证自己的猜想,取滤液于试管中,向其中滴加少量的硫酸钠溶液,观察到无明显现象。由此B同学得出结论:自己的猜想不成立,A同学的猜想成立。
【评价与交流】请你评价B同学的结论:(3)_____________________。同学们经过讨论后一致认为:B同学在验证自己的猜想时,若将所加试剂调换成足量的另一种试剂(4)_____________(填化学式),既能验证自己的猜想.也能确定滤液中的离子成分。
C同学取该试剂进行实验,最终确定了滤渡中的离子成分。
【归纳与总结】通过上述实验我们能够总结出:在确定化学反应后所得溶液中的离子成分时,一般应加入(5)___________________,验证(6)____________________________就可以确定溶液中的离子成分。
【2015年湖北省十堰市】某学习小组探究氢氧化钙溶液的化学性质,并作了延伸探究。
探究一:甲同学设计了如下实验方案,请你帮助完成实验报告。

【提出问题】实验方案(3)褪色后溶液中的溶质是什么?
【查阅资料】氯化钙溶液呈中性。
【作出猜想】乙同学从反应情况分析,溶液中除含少量酚酞外,溶质可能有以下三种情况:
①氯化钙 ②氯化钙和氯化氢 ③氯化钙和氢氧化钙
【分析讨论】丙同学从实验现象分析得出:猜想③肯定不合理,其理由是 。

探究二:丁同学为进一步验证乙同学的猜想,设计实验如下:将实验方案(3)褪色后溶液倒入烧杯中,向其中逐滴滴加稀碳酸钠溶液至过量,边滴加边振荡。实验后得出产生沉淀质量与碳酸钠溶液体积之间的关系,如图所示。写出实验过程中的现象 。
【得出结论】乙同学的猜想中, (填序号)合理。
【反思讨论】学习小组结合图像,分析了丁同学实验过程中烧杯内溶液的变化。下列说法正确的是 。(填序号)
| A.溶液质量逐渐增大 | B.氯化钠质量逐渐增大,V2后不变 |
| C.氯化钙的质量先增大后减小 | D.溶液的pH一直增大 |
试题篮
()