A、B、C、D、E分别为氧化铁、氢氧化钡溶液、稀硫酸、二氧化碳、一氧化碳中的一种物质,通常状况下B为固体,如图,用圆圈表示这五种物质,用“—”表示两种物质可以反应,用“→”表示一种物质可以转化为另一种物质。
(1)请在图中标出五种物质的化学式;
(2)A与D反应的化学方程式________________________:
(3)A与B反应的现象_______________________________。
在酸、碱、盐中,有A、B、C、D四种无色溶液和一种蓝色溶液(均含一种溶质),它们有如下反应和转化关系(说明:“ ”表示两者反应,“
”表示两者反应,“ ”表示转化成某物质,有些生成物已略去)。回答:
”表示转化成某物质,有些生成物已略去)。回答:
(1)写出生成蓝色沉淀和白色沉淀的化学反应方程式______________________________;
(2)写出A→B反应时的现象是_______________________________;
(3)将A、B、C、D溶液中溶质的化学式填入图中圆圈内。
已知:A、B、C、D是初中化学常见的物质,其中A、C为化合物,B、D为单质,它们之间能够发生如下反应: 
请回答:
(1)若D为密度最小的气体,请写出一个符合要求的化学方程式,并指出实验室收集D气体的方法。
(2)若A为黑色固体,C为使澄清石灰水变浑浊的气体,请写出一个符合要求的化学方程式,并指出B的一种用途。
A~E均为初中化学常见物质,A、B、C、D、E均含有同一种元素,B常用于改良酸性土壤.它们之间的相互转化关系如图所示:(图中“→”表示物质间存在转化关系,部分生成物已略去).请回答下列问题:
(1)B的化学俗名是 。写出下列物质的化学式:A 、C 。
(2)有关反应的化学方程式为:
C→D 。它的基本反应类型是 ,B→E 。
(7分)下图中的六个圆A、B、C、D、E、F分别表示六种物质,蓝色溶液A与C反应能生成两种沉淀,B为氧化物,C、D、E、F分别是碳酸钠溶液、稀硫酸、氢氧化钡溶液和氢氧化钠溶液中的一种,E中溶质可用于生产洗涤剂。用“→”表示一种物质能转化为另一种物质,用两圆相切或“——”表示两种物质可以发生化学反应,六种物质之间的部分反应及转化关系如右图所示。请利用初中化学知识回答下列问题:
(1)写出以下物质(或溶质)的化学式;(3分)
B________ E_______F________
(2)写出C与A反应的化学方程式为 __________________
(3)写出C→D的化学方程式_________________________
下列用字母表示的物质由H、C、O、Na、Cl、Ca、Fe中的一种或几种元素组成,它们是初中化学常见的物质。
(1)A溶于水放出大量的热,在空气中极易潮解。A的俗称为 。
(2)B为红色的固体,B、C固体分别与D的溶液反应后分别生成E、F,E、F含有两种相同元素且两种物质的溶液颜色不同。则E、F含有的相同元素元素是 ;B与D溶液反应的化学方程式为 ;B与某气体反应生成C,则该反应的化学方程式为 。
(3)取G的固体53g与足量的D溶液反应产生22g气体,则G与D溶液反应的化学方程式为 。
一种工业废水中含有大量的硫酸亚铁、少量硫酸铜和污泥(污泥不溶于水,且不参与化学反应)。某同学设计了一个既经济又合理的实验方案,制备硫酸亚铁晶体(FeSO4·7H2O)并回收铜。方案流程如下:
【查阅资料】FeSO4·7H2O受热易分解。
回答下列问题:
(1)加入过量试剂a的目的是 。
(2)操作③中产生气体的化学方程式是 。
(3)下列说法正确的是 。
| A.溶液1中的溶质质量一定大于溶液2中的溶质质量 |
| B.溶液3中的质量分数大于或等于溶液2 |
| C.操作④中可以用蒸发溶剂结晶的方法 |
| D.操作③中所加物质一定要适量 |
A、B、C、D是初中化学常见的四种物质,分别由H、C、O、S、Cu、Fe中的一种或几种元素组成,其中A为单质。
(1)若常温下A、B为气体,C、D为液体且组成相同。一定条件下C或D分解时均能生成A;A与B反应能生成C。D为 ;A与B反应的化学方程式为 。
(2)若A、B为固体,C、D为溶液。将A分别放入C、D中,均得到浅绿色溶液;B分别放入C、D中,一会儿D溶液变为黄色。B为 ;C、D溶液中溶质分别为 ;B能转化为A,反应的化学方程式为 。
含锌30%的黄铜用作弹壳的制造。现有一批使用过的、锈迹斑斑的弹壳,处理这些弹壳可以制得铜和硫酸锌,其主要过程如下图所示。
提示:弹壳上的锈主要为Cu2(OH) 2CO3,能与稀硫酸反应得到硫酸铜溶液;弹壳中其他杂质不溶于水、不参加反应。
(1)固体D为 。
(2)溶液A中加入E后发生反应的化学方程式为 。
工业废水中含有硫酸亚铁、硫酸铜和污泥。某同学设计了利用废水制备硫酸亚铁晶体(FeSO4·7H2O)并回收铜的实验方案,流程如下:
已知:硫酸亚铁晶体受热易分解。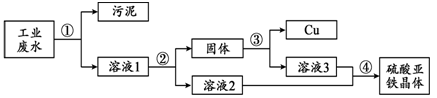
回答下列问题:
(1)步骤②中需加入的物质及目的是 。
(2)步骤③中发生反应的化学方程式为 。
(3)步骤④的操作是蒸发浓缩、降温结晶、 。
在复习课上,化学老师指导学生从不同的角度对化学反应进行比较和归纳。例如:氢气、一氧化碳、甲烷在空气中燃烧都产生蓝色火焰;氧化钙、氢氧化钙、碳酸钙等与盐酸反应时生成物中都含有氯化钙和水。同学们兴趣很高,也对学过的化学反应进行了归纳
(以下涉及的物质由C、H、O、Na、Cl、Fe、Ca中的一种或几种元素组成)。
(1)同学们归纳出能生成二氧化碳的化学反应,写出单质A燃烧生成二氧化碳的化学方程式_______________。
(2)某元素的单质B及其氧化物C分别可以和溶液D反应,分别生成浅绿色溶液和黄色溶液。写出B与D溶液、C与D溶液反应的化学方程式__________、__________。
(3)E、F、G分别与溶液D反应,均能生成两种维持人体正常生理活动所必需的物质。且E、F属于同一类别,G的俗称是_________。如果E由四种元素组成,E的溶液能与氢氧化钙溶液反应,得到白色沉淀和G的溶液,写出该反应的化学方程式_______。
某金属冶炼厂的管道烟泥中含有某些单质,其中Cu约占10.3%、Zn约占5.0%、
S约占1.2%。现欲回收铜和锌,并对硫进行环保处理,主要步骤如下图所示: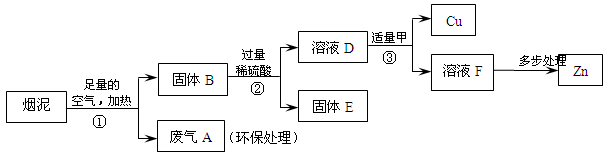
已知:加热的条件下,Zn、Cu都可以与氧气反应生成相应的金属氧化物;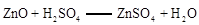 ;
;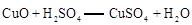
(1)步骤①产生的废气A中,一定含有的有害气体是_____。
(2)步骤③中反应的化学方程式是______________。
(3)下列说法正确的是__________。
a.②、③中的操作均包含过滤
b.溶液D和溶液F中ZnSO4的质量相等
c.溶液D中ZnSO4的质量大于CuSO4的质量
d.若步骤①中空气不足量,不会导致锌的回收率降低
硬水受热后会产生水垢,水垢的主要成分是CaCO3和Mg(OH)2。 实验室由水垢制取纯净CaCl2固体的流程如下:
请按要求填空:
(1)酸A是人体胃酸的主要成分,酸A的化学式是 ;
(2)步骤①中生成气体的化学反应方程式是 ;步骤②中生成沉淀的化学反应方程式是 ;
(3)步骤④加适量酸A的作用是 ;
(4)步骤⑤是利用 的方法得到氯化钙固体。
一包白色粉末由硫酸铜、碳酸钙、氯化钡、硫酸钠、氢氧化钠中的三种混合而成,为探究其组成,进行以下实验,分析实验过程,回答;
(1)白色粉末中一定有 ,一定没有 ;
(2)白色粉末的三种成分的可能组合为 , .
试题篮
()