将过量的
溶液滴入到一定量
溶液中得到蓝色固体。某研究性学习
小组对蓝色固体的成分进行了如下探究。请完成下列各题:
(一)猜想与假设:
猜想一:固体为
,理由:(用化学反应方程式表示)。
猜想二:固体为
,理由:
溶液呈(填"酸"或"碱")性。
猜想三:固体为
和
的混合物。
(二)资料查阅:
①
和
晶体均不带结晶水;
②
、
受热易分解,各生成对应的两种氧化物。
(三)设计与实验:
Ⅰ.固体的获取:
(1)将反应后的固、液混合物经、洗涤、低温烘干得蓝色固体。
(2)判断固体已洗净的方法及现象。
Ⅱ.用下图所示装置,定性探究固体的成分。

(3)若用装置
、
组合进行实验,
中无现象,则猜想正确;
(4)若用装置
、
组合进行实验,
中无现象,则猜想正确;
(5)小组同学将装置按
、、(填"
"、"
")的顺序组合进行实验,验证出猜想三是正确的,实验中:
中的现象为,
中的现象为。结论:固体为
和
的混合物。
Ⅲ.固体成分定量测定:
已知
的分解温度为
,
的分解温度为
。设固体的组成为
。小组同学用热分析仪对固体进行热分解,获得相关数据,绘成固体质量变化与分解温度的关系如右图,请根据图示回答下列问题:

(6)写出
、
段发生反应的化学方程式:
段:;
段:;
(7)通过计算可得:
。
(8)若将
剩余固体继续加热到更高的温度,发现固体质量减少了
后质量不再改变,写出此过程中可能发生反应的化学方程式:。
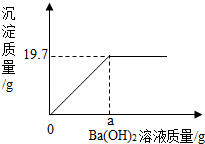
固体氢氧化钠放置在空气中容易变质转化为碳酸钠。现称取一久置于空气中的烧碱样品10.6g完全溶于蒸馏水中配成100g溶液,向其中滴加质量分数为8.55%的氢氧化钡溶液,产生沉淀与所加氢氧化钡溶液的质量关系如图所示。请通过计算回答:
(1)该烧碱样品变质的程度为 (填“部分变质”或“全部变质”)。
(2)a= g。
(3)当沉淀刚好达到最大质量时,溶液中溶质质量分数为多少?(写出计算过程,计算结果精确到0.01%)
今年5月,运用"蓝鲸一号"钻探平台,我国南海神狐海域首次实现可燃冰试采成功.
材料一:可燃冰、学名天然气水化合物,其化学式为CH 4•8H 2O.它是天然气的固体状态(因海底高压).埋于海底地层深处的大量有机质在细菌的分解作用下,最后形成石油和天然气(石油气),其中许多天然气被包进水分子中,在海底的低温(2~5℃)与压力下结晶,形成"可燃冰".
材料二:"蓝鲸一号"钻探平台设计和建造过程刷新了多项世界纪录,它长117米,宽92.7米,高118米,质量为42000吨.
请根据上述材料回答:
(1)形成可燃冰需要一定的生态环境.
①海底地层深处,这些分解有机质的细菌能很好的生存,体现了生物对环境的 .这些细菌分解有机质 (选填"需要"或"不需要")氧气,这些细菌与真菌在细胞结构上的主要区别是 .
②在开采过程中,极少量的垃圾废弃物没有对海洋环境造成破坏,这主要是因为海洋生态系统有 的能力.
(2)形成可燃冰的其中一个条件是有甲烷气源.
①可燃冰(CH 4•8H 2O)中C:H:O的元素质量比是 ,甲烷属于 (选填"有机物"或"无机物").
②与石油、煤等化石燃料相比较,开采可燃冰的积极意义有(写一条) .(可燃冰在空气中燃烧的化学方程式为CH 4•8H 2O+2O 2  CO 2+10H 2O)
CO 2+10H 2O)
(3)如果南海海水的密度是1.03×10 3千克/米 3,"蓝鲸一号"钻探平台漂浮海面受到海水浮力是 牛,浸入海水的体积至少需要 米 3,开采出的可燃冰可以直接在管口点燃,说明已经成为气体,从固体变成气体的原因可能是 .
从古至今,铁及其化合物一直被人类广泛应用。
(一)铁及其化合物的应用

(1)明代科学著作《天工开物》中记载:
①“其器冶铁锥,其尖使极刚利”,“铁锥”为开挖盐井的工具。所取盐井水“入于釜中煎炼顷刻结盐”,“金”指生铁制作的铁锅。生铁属于 材料。上述描述中利用铁的 (选填序号)。
| A. |
a.导热性 |
| B. |
b.导电性 |
| C. |
c.硬度大 |
②“泥固塞其孔,然后使水转釉”是指高温下 将红砖中的
将红砖中的 转化为
转化为 而形成青砖。该转化的化学方程式为 。
而形成青砖。该转化的化学方程式为 。
(2)铁的化合物在现代更多领域发挥着重要作用。
①碳酸亚铁( )不溶于水,可作补血剂,服用后与胃酸反应生成 被人体吸收,促进血红蛋白的生成。
)不溶于水,可作补血剂,服用后与胃酸反应生成 被人体吸收,促进血红蛋白的生成。
②火星探测器发回的信息表明,火星上存在 ,从而证明火星表面曾经存在过水,其理由为 。
,从而证明火星表面曾经存在过水,其理由为 。
③活性 可除去石油开采过程中的有害气体
可除去石油开采过程中的有害气体 ,并获得
,并获得 ,原理如下。
,原理如下。
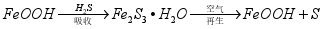
吸收中生成的另一种物质的化学式为 ,再生时发生反应的化学方程式为 。
(二) 的制备
的制备
用废铁屑(主要成分为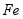 ,含少量
,含少量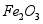 和
和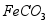 )制备
)制备 主要流程如下。
主要流程如下。
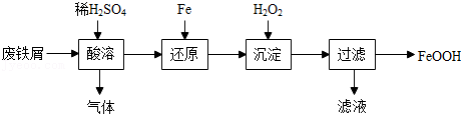
(1)酸溶时适当提高反应温度和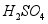 浓度,目的是 ,产生的气体为 。
浓度,目的是 ,产生的气体为 。
(2)还原发生的反应为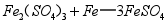 。
。
沉淀发生的反应为 。
。
沉淀时反应温度不宜太高,原因是 。
(3)沉淀时会有部分 与
与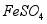 反应生成
反应生成 ,反应的化学方程式为 。
,反应的化学方程式为 。
(三) 的含量测定
的含量测定
已知: 及铁的氧化物加热分解的温度如下。
及铁的氧化物加热分解的温度如下。

称取含 的
的 样品76.6g,进行热分解实验。控制不同的温度对样品加热,测得剩余固体质量随温度的变化如图所示。
样品76.6g,进行热分解实验。控制不同的温度对样品加热,测得剩余固体质量随温度的变化如图所示。
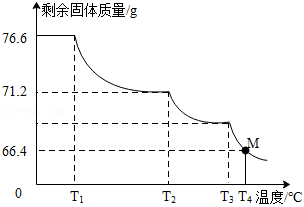
(1)样品中 的含量为 %(精确到0.1%)。
的含量为 %(精确到0.1%)。
(2)当加热到 时,M点固体的成分是 ,对应的质量比为 。
时,M点固体的成分是 ,对应的质量比为 。
绵阳西北部山区石灰石资源非常丰富,大量用于生产水泥。用石灰石和砂岩黏土高温煅烧得到一种新型水泥熟料,主要反应为: 。
(1)上述反应涉及四类化合物中的哪几类? 。
(2) 的化学式可表示为 ,含 44.8%的水泥熟料中含 的质量分数为 。
(3)在实验室用如图所示方法粗略测定石灰石中 的质量分数,无需测定的数据是 (填序号)。
| A. |
取用石灰石样品的质量 |
| B. |
倒入的过量稀盐酸的质量 |
| C. |
盐酸接触样品前电子秤的读数 |
| D. |
反应停止后电子秤的读数 |
(4)用含 90%的石灰石1000t生产新型水泥熟料,理论上会排放 多少吨?(无计算过程不给分)

氢是实现碳中和的能源载体。
(1)煤制氢的原理可表示为 。
① 中肯定含有的元素是 。
②煤制氢的不足是 (写出一点)。
(2)甲烷制氢包括重整、转化和分离等过程。甲烷制氢过程中产生的 和 的混合气分离得到 的过程如下:
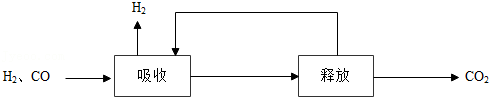
①海水作为吸收剂时,下列措施有利于海水吸收二氧化碳的是 (填序号)。
a.升高海水的温度
b.加快混合气的流速
c.增大气体的压强
②利用 溶液吸收 ,将其转化为 , 在加热条件下即可分解生成 。比较 和 分解反应的不同,可推知 的稳定性 (填“>”或“<”) 的稳定性。
③使用氢氧化钠溶液吸收二氧化碳并分离出氢气。补充完整氢氧化钠循环使用的方案。
步骤1:将氢气和二氧化碳的混合气通入足量的氢氧化钠溶液中。
步骤2:向步骤1所得的溶液中 。
步骤3:过滤,得滤渣和氢氧化钠溶液。
(3)某种利用太阳能制氢的过程如图1所示。
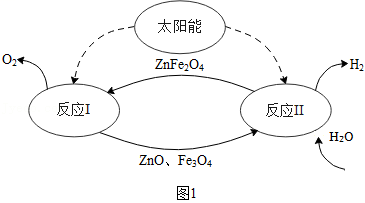
①反应I的基本类型为 。
②写出反应Ⅱ的化学方程式: 。
(4)我国2030~2050年各种能源使用预期情况如图2所示。
①图2所涉及的能源中,属于不可再生能源的是 。
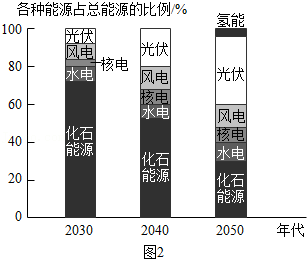
②2030~2050年,预期我国能源结构的变化趋势是 。
是化学实验中常见试剂。
(1)验证质量守恒定律。
步骤1:在锥形瓶中加入适量的 溶液,塞好橡胶塞。将几根铁钉用砂纸打磨干净,将盛有 溶液的锥形瓶和铁钉一起放在托盘天平上称量,记录所称质量为 。
步骤2:将铁钉浸入到 溶液中,塞好橡胶塞。观察实验现象,待反应有明显现象后,将盛有 溶液和铁钉的锥形瓶一起放在托盘天平上称量,记录所称质量为 。
①用砂纸将铁钉打磨干净的作用是 。
②步骤2中可观察到明显的实验现象是 。该变化可说明 和 的金属活动性由强到弱的顺序是 。
③若 ,可证明参加反应的 和 的质量总和等于 。
(2)探究 溶液对 分解具有催化作用。
①若要证明 溶液对 分解具有催化作用,除需证明 在反应前后化学性质和质量不发生改变外,还需证明的是 。
②为探究 在反应前后质量是否发生改变,某同学设计如下实验:
向 溶液中滴入10g a%的 溶液,待反应完全后,向试管中加入足量的 溶液,产生沉淀,过滤、洗涤、干燥,称量沉淀物为 。
上述实验步骤中若缺少“洗涤、干燥”,则通过沉淀物 计算出溶液中 的质量 。(填“大于”或“小于”或“等于”)
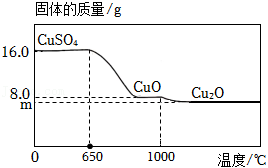
(3)将16.0g 置于坩埚中加热,固体质量与成分随温度变化的曲线如图所示。
①650℃时, 开始发生分解反应,生成 和另一种氧化物 , 的化学式为 。
②1000℃时, 开始发生分解反应,生成 和 。计算图中 的值。(写出计算过程,否则不得分)
已知H2与菱铁矿(主要成分 其他成分不参与反应)反应制成纳米铁粉。某小组进行探究并完成如下实验:
查阅资料:① 能与 反应生成 , 能使无水硫酸铜变蓝
② 与无水硫酸铜不反应
(1)某同学探究反应后气体成分,先将反应后气体通入无水硫酸铜,无水硫酸铜变蓝,证明气体中含有______,再通入足量的澄清石灰水,澄清石灰水变浑浊,反应方程式为______。
(2)对剩余气体成分进行以下猜想:
猜想一: 猜想二:______ 猜想三: 和
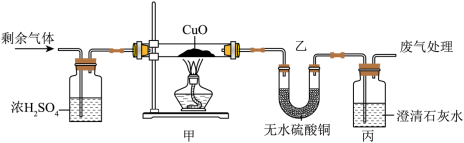
浓H2SO4的作用:______。
|
甲中现象:______。 乙中无水 变蓝 丙中变浑浊 |
猜想______正确 |
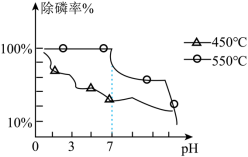
(3)热处理后的纳米铁粉能够除去地下水中的磷元素,如图所示 或者 热处理纳米铁粉的除零率以及 值如图所示,分析______ 时以及______(酸性或碱性)处理效果更好。
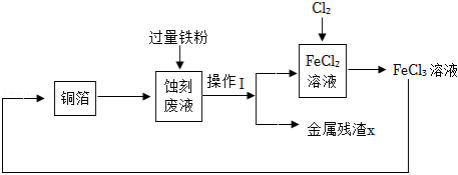
工业上用 溶液蚀刻铜箔制造印刷电路板,反应为 ,蚀刻废液又可再处理,实现资源回收和循环利用,其流程转化关系如图。
请回答相关问题。
(1)“蚀刻废液”的全部溶质有 和少量 。操作Ⅰ的名称是 。
(2)参照上述流程,画出由“金属残渣X”分离回收 和 溶液的简单流程图。
(3)上述流程中,能使三价铁转化为二价铁的物质有 。
(4)蚀刻掉128g铜,消耗 的质量为 g,理论上至少需要20% 溶液的质量为 g。(不需要写出计算过程)
硫酸是世界上产量最大、用途最广的酸,被称为“化学工业之母”。化学兴趣小组同学对硫酸进行了多角度的研究。
【物质制备】
(1)工业上采用接触法制硫酸:先煅烧黄铁矿得到 ,再将 经过一系列变化得到硫酸。 中硫元素的化合价是 。
【物质性质】
(2)用温度计的水银球一端蘸取浓硫酸,取出后在空气中放置一段时间,观察到温度计示数上升,是因为浓硫酸能吸收 ,并放出热量。
(3)请利用如图提供的仪器与药品,探究稀硫酸与氢氧化钠溶液的反应。
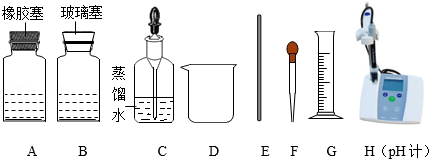
①取 (填“A”或“B”)中的氢氧化钠溶液5mL加入烧杯中,并插入pH计。
②从另一试剂瓶中取出稀硫酸逐滴加入①的溶液中,并用 (填仪器名称)不断搅拌。反应过程中溶液pH变化的部分数据如下表所示:
|
稀硫酸体积/mL |
0 |
2 |
4 |
6 |
8 |
…… |
|
溶液pH |
13.1 |
12.8 |
12.3 |
11.5 |
10.4 |
…… |
③在pH=12.8时,溶液中的溶质是 (填化学式)。
④滴加稀硫酸过程中,溶液pH不断减小的原因有:
a.硫酸与氢氧化钠发生了反应;
b.
⑤为证明溶液pH从13.1减小到10.4的过程中,④中原因a起主要作用,需设计的实验方案是 。
【定量研究】
(4)某工厂现有含碳酸钠的废水需要处理。为测定废水中碳酸钠的质量分数,化学兴趣小组同学取废水样品100g,加入溶质质量分数为10%的硫酸溶液9.8g,恰好完全反应,反应的化学方程式: (此废水中其他物质不与硫酸反应)。计算废水中碳酸钠的质量分数(写出计算过程)。
如图是氧气的实验室制取与性质实验。
(1)试管口棉花的作用是 。
(2)检验氧气集满的方法是 。
(3)制取氧气的主要步骤如下,正确的顺序是 (填序号)。
①装入药品,开始加热
②停止加热
③收集气体
④组装仪器,检查气密性
(4)硫在氧气中燃烧的现象是 。
(5)根据化学方程式计算,制取0.96g氧气,至少需要高锰酸钾的质量是多少?
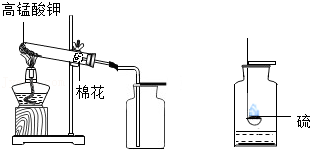
化学兴趣小组设计了如图所示两个装置,以 溶液为原料制备 ,可灵活控制气体的产生与停止。

(1)甲装置用 作催化剂,先用黏合剂将 粉末制成团状。
①仪器a的名称是 。
②团状 应放在 (填“试管底部”或“多孔隔板上”)。
③打开活塞K,经仪器a向试管中缓慢加入 溶液至浸没团状 ,立即产生 ,收集完后, (填操作),反应随后停止。
(2)乙装置用铂丝(可上下抽动)作催化剂。安全管下端浸没于 溶液中,将铂丝插入溶液,立即产生 。
①若烧瓶内压强过大,安全管中出现的现象是 。
②当出现上述现象时,应采取的措施是 。
(3)取100g 溶液加入乙装置的烧瓶中,完全反应后,测得生成2.56g 。计算 溶液的溶质质量分数(写出计算过程)。
实验室现有 ,块状大理石,稀盐酸,棉花
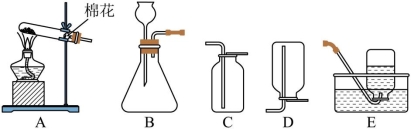
(1)亮亮根据现有药品制取氧气,方程式为______。制取一瓶较干燥的 应选择的发生装置和收集装置是______。(标号)
(2)根据现有药品选用______和稀盐酸反应制取 ,化学方程式为______。
(3)实验废液不能直接倒入下水道,取少量制备 后的废液于试管中,加入滴______(选填“紫色石蕊溶液”或“无色酚酞溶液”),溶液变红,则溶液显酸性。
高速钢是制造冰鞋冰刀的重要材料,其性能与含碳量关系密切。为测试冰刀中碳元素的质量分数,现取一定质量的冰刀于烧杯中,分3次每次加入100g溶质质量分数相同的稀硫酸,实验过程和数据如图所示。请根据相关信息回答下列问题。

(1)推算图中m的数值为 。
(2)请写出第2次反应后溶液中溶质的化学式 。
(3)计算冰刀中碳元素的质量分数(不考虑杂质,结果精确到0.01%)。
二甲基亚砜( )工业废渣含 及少量有毒的 ,以该废渣为原料制备农用 ,既实现资源回收利用又保护了环境。工艺流程如下:
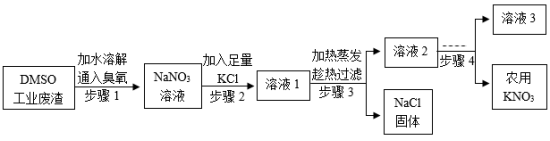
(1)农用 为农作物提供的营养元素有_______。
(2)步骤1的作用是除去 , 中氮元素的化合价为_______。
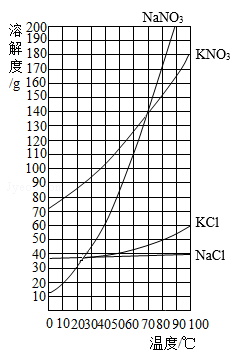
(3)结合溶解度曲线分析,步骤3“加热蒸发”时可控制只析出 固体,原因是_______。
(4)步骤4的操作是_______、过滤。
(5) 用量的估算依据是 (填标号)。
| A. | 与 的粒子个数比为 |
| B. | 与 的质量比为 |
| C. | 与 在溶液中的质量分数之比为 |
(6)该工艺所得农用 混有一定量 。取 样品加足量水溶解,向溶液中加入足量的 溶液,生成沉淀的质为 ,则样品中杂质 的质量是_____ ,样品含 _______ (质量分数)。
(相对分子质量: )
试题篮
()