下列式子中,属于水解反应的是
A.H2O+H2O H3O++OH- H3O++OH- |
B.HCO3-+OH- H2O+CO32- H2O+CO32- |
C.CO2+H2O H2CO3 H2CO3 |
D.CO32―+H2O HCO3-+OH- HCO3-+OH- |
用物质的量都是0.1mol的HCN和NaCN混合后配成1L溶液,已知溶液中的c(CN-)<c(Na+),下列关系式正确的是( )
| A.c(H+)>c(OH-) | B.c(HCN)<c(CN-) |
| C.c(CN-)+c(OH-)=0.1mol·L-1 | D.c(HCN)+c(CN-) =0.2mol·L—11 |
0.1 mol•L-1 KHS溶液中下列表达式不正确的是( )
| A.c(K +)+c(H+)= c(OH-)+ c(HS-)+2 c(S2-) | B.c(K+)> c(HS-)> c(OH-)> c(S2-)> c(H+) |
| C.c(HS-)+ c(S2-)+ c(H2S)=" 0.1" mol•L-1 | D.c(K+)> c(HS-)> c(OH-)> c(H2S)> c (H+) |
用酒精灯加热下列溶液,蒸干后灼烧,所得固体质量最大的是( )
| A.20 mL 2 mol/L FeCl3溶液 | B.40 mL 1 mol/L NaHCO3溶液 |
| C.20 mL 1 mol/L Na2SO3溶液 | D.40 mL 2 mol/L NH4HCO3溶液 |
若pH=3的酸溶液和pH=11的碱溶液等体积混合后溶液呈酸性,其原因可能是( )
| A.生成了一种强酸弱碱盐 |
| B.弱酸溶液和强碱溶液反应 |
| C.强酸溶液和弱碱溶液反应 |
D.一元强 酸溶液和一元强碱溶液反应 酸溶液和一元强碱溶液反应 |
在pH为4-5的环境中,Cu2+和Fe2+不水解,而Fe3+几乎完全水解。工业上制CuCl2是将浓盐酸用蒸汽加热到80℃左右。在漫漫加入粗氧化铜(含杂质FeO),充分搅拌使之溶解。欲除去所得CuCl2溶液中的杂质离子,下列方法中可行的是:
| A.加入HNO3将Fe2+氧化成Fe3+,再加水稀释至pH4-5 |
| B.向溶液中通入Cl2,再加入CuO粉末调节至pH4-5 |
| C.向溶液中通入Cl2,在通入NH3调节至pH4- |
| D.向溶液中通入H2O2, 再加入CuO粉末调节至pH4-5 |
在常温下,下列五种溶液:
①0.1mol/L ②0.1mol/L
②0.1mol/L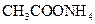 ③0.1mol/L
③0.1mol/L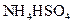
④0.1mol/L 和0.1mol/L
和0.1mol/L 混合液 ⑤0.1mol/L
混合液 ⑤0.1mol/L
请根据要求填写下列空白:
(1)溶液①呈 性(填“酸”、“碱”或“中”),其原因是(用离子方程式表示)
(2)在上述五种溶液中, 最小的是 ;
最小的是 ; 最小的是 (填序号)
最小的是 (填序号)
(3)比较溶液②、③中 的大小关系是② ③(填“>”、“<”或“=”)
的大小关系是② ③(填“>”、“<”或“=”)
(4)在溶液④中, 离子的浓度为0.1mol/L; 和 离子的物质的量浓度之和为0.2mol/L。
和 离子的物质的量浓度之和为0.2mol/L。
(5)常温下,测得溶液②的 ,则说明
,则说明 的水解程度 (填“>”、“<”或“=”)
的水解程度 (填“>”、“<”或“=”) 的水解程度,
的水解程度, 与
与 浓度的大小关系是:
浓度的大小关系是:
 (填“>”、“<”或“=”)
(填“>”、“<”或“=”)
下列有关0.1mol·L-1NaHCO3溶液中浓度关系式正确的是
| A.c(Na+)>c(HCO3-)>c(CO32-)>c(H+)>c(OH-) |
| B.c(Na+)> c(CO32-) > c(HCO3-) > c(OH-) >c(H+) |
| C.c(Na+)= c(HCO3-)+2 c(CO32-)+ c(H2CO3) |
| D.c(Na+)+ c(H+)= c(HCO3-)+2 c(CO32-)+ c(OH-) |
常温下,用 0.1000 mol·L NaOH溶液滴定 20.00mL0.1000 mol·L
NaOH溶液滴定 20.00mL0.1000 mol·L CH3COOH溶液所得滴定曲线如右图。下列说法正确的是
CH3COOH溶液所得滴定曲线如右图。下列说法正确的是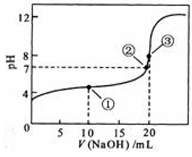
A.点①所示溶液中: |
B.点②所示溶液中: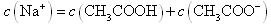 |
C.点③所示溶液中: |
| D.滴定过程中可能出现: |
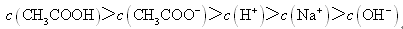
常温下,0.2 mol/L CH3COOH溶液与0.1 mol/L NaOH溶液等体积混合后(忽略混合前后溶液体积的变化),溶液的pH<7,则下列有关此溶液的叙述正确的是
| A.溶液中由水电离产生的H+浓度为1×10-7 mol/L |
| B.c(CH3COO-)+c(CH3COOH)-c(Na+)=0.05 mol/L |
| C.溶液中CH3COOH的电离程度小于CH3COONa的水解程度 |
| D.溶液中离子浓度的大小关系为:c(Na+)>c(CH3COO-)>c(H+)>c(OH-) |
已知某酸H2B在水溶液中存在下列关系:
①H2B===H++HB-,②HB- H++B2-.关于该酸对应的酸式盐NaHB的溶液,下列说法中,一定正确的是
H++B2-.关于该酸对应的酸式盐NaHB的溶液,下列说法中,一定正确的是
A.NaHB属于弱电解质
B.溶液中的离子浓度c(Na+)>c(HB-)>c(H+)>c(OH-)
C.c(Na+)=c(HB-)+c(B2-)+c(H2B)
D.NaHB和NaOH溶液反应的离子方程式为H++OH-===H2O
下列关系式正确的是
A.常温下PH=2的甲酸与pH=12的烧碱溶液等体积混合: |
B. 溶液中: 溶液中: |
C. 溶液加水稀释后,恢复至原温度,所有离子浓度均减小 溶液加水稀释后,恢复至原温度,所有离子浓度均减小 |
| D. 1L 0.3mol ?L-1NaOH溶液吸收标准状况下4. 48L CO2: |

(8分)常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表:
| 实验 编号 |
HA物质的量 浓度(mol· L-1) |
NaOH物质的 量浓度(mol· L-1) |
混合溶液的 pH |
| 甲 |
0.2 |
0.2 |
pH=a |
| 乙 |
c1 |
0.2 |
pH=7 |
| 丙 |
0.2 |
0.1 |
pH>7 |
| 丁 |
0.1 |
0.1 |
pH=9 |
请回答:
(1)不考虑其他组的实验结果,单从甲组情况分析,
若a________7(填“>”、“<”或“=”),则HA为强酸;
若a________7(填“>”、“<”或“=”),则HA为弱酸。
(2)在乙组中混合溶液中离子浓度c(A-)与c(Na+)的大小关系是( )
| A.前者大 | B.后者大 |
| C.二者相等 | D.无法判断 |
(3)从丙组实验结果分析,HA是________酸(填“强”或“弱”)。该混合溶液中离子浓度由大到小的顺序是___________________________________________。
(4)丁组实验所得混合溶液中由水电离出的c(OH-)=________mol·L-1。
(8分)Ⅰ.(1)饱和氯化铵溶液显酸性,原因是
________________________________________________________________________
________________________________________________________________________;
向饱和氯化铵溶液中加入少量Mg(OH)2固体,固体完全溶解;其合理的解释(用相关离子方程式表示)为
________________________________________________________________________
________________________________________________________________________。
(2)向Mg(OH)2悬浊液中加入适量CH3COONH4溶液,
Mg(OH)2能否完全溶解________(填“能”或“否”),理由是
________________________________________________________________________
________________________________________________________________________。
Ⅱ.硫酸是强酸,中学阶段将硫酸在水溶液中看作完全电离。但事实是,硫酸在水中的第一步电离是完全的,第二步电离并不完全,其电离情况为:H2SO4===H++HSO4-,HSO4-===H++SO42-。
请回答下列有关问题:
(1)Na2SO4溶液呈________(填“弱酸性”“中性”或“弱碱性”),其理由是________________________________________________________________________
(用离子方程式表示);
(2)H2SO4溶液与BaCl2溶液反应的离子方程式为
________________________________________________________________________
________________________________________________________________________。
(3)在0.10 mol·L-1的Na2SO4溶液中,下列离子浓度关系正确的是________(填写编号);
| A.c(Na+)=c(SO42-)+c(HSO4-)+c(H2SO4) |
| B.c(OH-)=c(HSO4-)+c(H+) |
| C.c(Na+)+c(H+)=c(OH-)+c(HSO4-)+2c(SO42-) |
| D.c(Na+)=2c(SO42-)+2c(HSO4-) |
(4)写出NaHSO4溶液中溶质电离常数(Ka)的表达式________________;
(5)若25℃时,0.10 mol·L-1的NaHSO4溶液中c(SO2-4)=0.029 mol·L-1,则0.10 mol·L-1的H2SO4溶液中c(SO42-)________0.029 mol·L-1(填“<”“>”或“=”),其理由是________________________________________________________________________;
(6)如果25℃时,0.10 mol·L-1H2SO4溶液的pH=
-lg 0.11,则0.10 mol·L-1的H2SO4溶液中c(SO42-)=________mol·L-1。
(8分)已知:A酸的溶液pH=a,B碱的溶液pH=b。
(1)若A为盐酸,B为氢氧化钡,且a+b=14,两者等体积混合,溶液的pH=________。酸碱按体积比为1 ∶10混合后溶液显中性,则a+b=________。
(2)若A为醋酸,B为氢氧化钠,且a=4,b=12,那么A溶液中水电离出的氢离子浓度为________mol·L-1,B溶液中水电离出的氢离子浓度为________mol·L-1。
(3)若A为醋酸,B为氢氧化钠,且a+b=14,用体积为VA的醋酸和体积为VB的氢氧化钠溶液混合后,溶液显中性,则其体积关系为VA________VB(填“>”、“<”或“=”,下同),混合后溶液中的离子浓度关系为c(Na+)________
c(CH3COO-)。
(4)若A的化学式为HR,B的化学式为MOH,且a+b=14,两者等体积混合后溶液显碱性。则混合溶液中必定有一种离子能发生水解,该水解反应的离子方程式为________________________________________________________________________
________________________________________________________________________。
试题篮
()