已知:苯甲酸在水中的溶解度为:0.18g(4℃)、0.34g(25℃)、6.8g(95℃)。乙醚的沸点为34.6℃。实验室常用苯甲醛制备苯甲醇和苯甲酸,其原理为:2C6H5―CHO+NaOH C6H5―CH2OH+C6H5―COONa
C6H5―CH2OH+C6H5―COONa
实验步骤如下:
①向如图所示装置中加入适量 NaOH、水和苯甲醛,混匀、加热,使反应充分进行。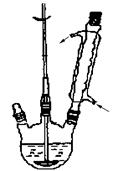
②从冷凝管下口加入冷水,混匀,冷却。倒入分液漏斗,用乙醚萃取、分液。水层保留待用。将乙醚层依次用10%碳酸钠溶液、水洗涤。
③将乙醚层倒入盛有少量无水硫酸镁的干燥锥形瓶中,混匀、静置后将其转入蒸馏装置,缓慢均匀加热除去乙醚,收集198℃~204℃馏分得苯甲醇。
④将步骤②中的水层和适量浓盐酸混合均匀,析出白色固体。冷却、抽滤得粗产品,将粗产品提纯得苯甲酸。
(1)步骤②中,最后用水洗涤的作用是 。将分液漏斗中两层液体分离开的实验操作方法是:先 后 。
(2)步骤③中无水硫酸镁的作用是 。
(3)步骤④中水层和浓盐酸混合后发生反应的化学方程式为 ;将反应后混合物冷却的目的是 。
(4)抽滤装置所包含的仪器除减压系统外,还有 、 (填仪器名称)。
下图是实验室用乙醇与浓硫酸和溴化钠反应来制备溴乙烷的装置,反应需要加热,图中省去了加热装置。有关数据见表3:
| |
乙醇 |
溴乙烷 |
溴 |
| 状态 |
无色 液体 |
无色 液体 |
深红棕色 液体 |
| 密度/g·cm-3 |
0.79 |
1.44 |
3.1 |
| 沸点/℃ |
78.5 |
38.4 |
59 |
表3.乙醇、溴乙烷、溴有关参数
(1)制备操作中,加入的浓硫酸必需进行稀释,其目的是 (选填序号)。
a.减少副产物烯和醚的生成 b.减少Br2的生成
c.减少HBr的挥发 d.水是反应的催化剂
(2)写出溴化氢与浓硫酸加热时发生反应的化学方程式 。
(3)图中试管C中的导管E的末端须在水面以下,其原因是 。
(4)加热的目的是 。
(5)为除去产品中的一种主要杂质,最好选择下列 (选填序号)溶液来洗涤产品。
A.氢氧化钠 B.碘化亚铁 C.亚硫酸钠 D.碳酸氢钠
(6)第(5)步的实验所需要的玻璃仪器有 。
邻叔丁基对苯二酚(TBHQ) 是一种新颖的食品抗氧剂,其制备原理为:
实验过程中的主要步骤如下:
步骤1.向三口烧瓶中加入5.5g对苯二酚,5.OmL浓磷酸及20mL二甲苯(装置如图所示),启动搅拌器。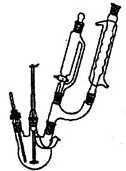
步骤2.缓缓加热到100-110°C,慢慢滴加7.5mL叔丁醇和5mL二甲苯组成的溶液,30-60min内滴完。
步骤3.升温到135-140°C,恒温回流2.5h。
步骤4.将反应液冷却到120°C,直到反应完成
步骤5.将反应液倒入烧杯,并用热水洗涤三口烧瓶,洗液并入烧杯中。
步骤6.冷却结晶,抽滤,回收滤液中的二甲苯和磷酸
步骤7.用二甲苯重结晶、脱色、冷水洗涤、干燥
(1)磷酸在实验中的作用是_____。
(2)本实验中二甲苯的作用是_____。
(3)步骤4中反应完成的标志是_____。
(4)步骤7脱色时,可用的脱色剂是_____。
(5)对合成得到的产品表征,还需要的主要现代分析仪器是_____、_____。
乙酰基二茂铁是常用的汽油的抗震剂,由二茂铁合成乙酰基二茂铁的原理如下:

其实验步骤如下:
步骤1:如图Ⅰ所示,取1 g二茂铁与3 mL乙酸酐于装置中,开通搅拌器,慢慢滴加85%磷酸1 mL,加热回流5 min。
步骤2:待反应液冷却后,倒入烧杯中加入10 g碎冰,搅拌至冰全部融化,缓慢滴加NaHCO3溶液中和至中性,置于冰水浴中15 min。抽滤,烘干,得到乙酰基二茂铁粗产品。
步骤3:将乙酰基二茂铁粗产品溶解在苯中,从图Ⅱ装置的分液漏斗中滴下,再用乙醚淋洗。
步骤4:将其中一段时间的淋洗液收集,并进行操作X,得到纯净的针状晶体乙酰基二茂铁并回收乙醚。
(1)步骤2中的抽滤操作,除烧杯、玻璃棒外,还必须使用属于硅酸盐材质的仪器有 。
(2)步骤2中不需要测定溶液的pH就可以判断溶液接近中性,其现象是 。
(3)步骤3将粗产品中杂质分离实验的原理是 。
(4)步骤4中操作X的名称是 ,该操作中不能使用明火的原因是 。
(5)为确定产品乙酰基二茂铁中是否含有杂质二乙酰基二茂铁( ),可以使用的仪器分析方法是 。
),可以使用的仪器分析方法是 。
三苯甲醇(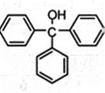 )是一种重要的化工原料和医药中间体,实验室合成三苯甲醇的合成流程如图1所示。
)是一种重要的化工原料和医药中间体,实验室合成三苯甲醇的合成流程如图1所示。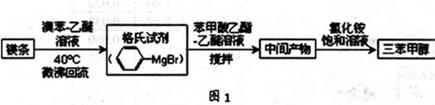
已知:i)格氏试剂容易水解,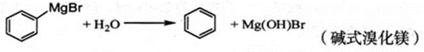
ii)相关物质的物理性质如下:
| 物质 |
熔点(℃) |
沸点(℃) |
溶解性 |
| 三苯甲醇 |
164.2 |
380 |
不溶于水,溶于乙醇、乙醚等有机溶剂 |
| 乙醚 |
—116.3 |
34.6 |
微溶于水,溶于乙醇、苯等有机溶剂 |
| 溴苯 |
—30.7 |
156.2 |
不溶于水,溶于乙醇、乙醚等多数有机溶剂 |
| 苯甲酸乙酯 |
—34.6 |
212.6 |
不溶于水 |
| Mg(OH)Br |
常温下为固体 |
能溶于水,不溶于醇、醚等有机溶剂 |
iii)三苯甲醇的相对分子质量是260,纯净固体有机物一般都有固定熔点。
请回答以下问题:
(1)实验室合成三苯甲醇的装置图2,写出玻璃仪器A的名称: ,装有无水CaCl2的仪器A的作用是: ;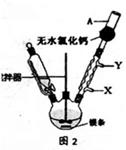
(2)制取格氏试剂时要保持微沸,可以采用水浴加热,优点是 ,微沸回流时冷凝管中水流的方向是: (填“X→Y”或“Y→X”);
(3)制得的三苯甲醇粗产品中,含有乙醚、溴苯、苯甲酸乙酯等有机物和碱式溴化镁等杂质,可以设计如下提纯方案,请填写空白: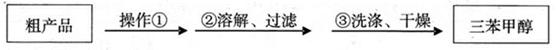
其中,操作①为: ;洗涤液最好选用: ;
A.水 B.乙醚 C.乙醇 D.苯
检验产品已经洗涤干净的操作为: ;
(4)纯度测定:称取2.60g产品,配成乙醚溶液,加入足量金属钠(乙醚与钠不会反应),充分反应后,测得生成气体体积为100.80m L(标准状况)。产品中三苯甲醇质量分数为 (保留两位有效数字,已知三苯甲醇的分子式为C19H16O,相对分子质量为260)。
苯酚具有弱酸性,在空气中易被氧化。工业上以苯、硫酸、氢氧化钠、亚硫酸钠为原料合成苯酚的方法可简单表示为:
(1)根据上述反应判断下列三种物质的酸性由强到弱的顺序为 (填序号)。
A. B.
B. C.H2SO3
C.H2SO3
(2)步骤④与使用CO2相比,使用SO2的优点是 (答一个方面)。
(3)经反应④得到的产物除 外、可能还含有OH-、SO32-、HSO3-等微粒。请设计实验方案,证明溶液中存在
外、可能还含有OH-、SO32-、HSO3-等微粒。请设计实验方案,证明溶液中存在 、SO32-、HSO3-,写出实验步骤、预期现象和结论。
、SO32-、HSO3-,写出实验步骤、预期现象和结论。
限选仪器及试剂:试管、滴管、玻璃棒、过滤装置和滤纸;2mol·L-1盐酸、1mol·L-1 BaCl2溶液、品红溶液、0.01 mol·L-1酸性KMnO4溶液、1 mol·L-1 FeCl3溶液、饱和溴水等。
| 实验步骤 |
预期现象和结论 |
| 步骤1:取少量待测液于试管中,加入足量的1 mol·L-1BaCl2溶液,静置、过滤,得滤液和沉淀。将滤液分置于试管A、B中,沉淀置于试管C中。 |
 |
| 步骤2:往试管A中加入 。 |
,说明溶液中含有HSO3-。 |
| 步骤3:往试管B中加入 。 |
。 |
| 步骤4:往试管C中加入2 mol·L-1盐酸酸化,再滴入1~2滴品红溶液。 |
,说明溶液中含有SO32-。 |
(4)纯度测定:称取1.00g产品溶解于足量温水中,向其中加入足量饱和溴水(产品中除苯酚外,不含其它与饱和溴水反应生成沉淀的物质),苯酚全部生成三溴苯酚沉淀,经过滤、洗涤、干燥后,称得沉淀质量为3.31g,则产品中苯酚的质量分数为 。(苯酚的分子式为C6H6O,三溴苯酚的分子式为C6H3Br3O,它们的相对分子质量分别为94、331)
1,2-二溴乙烷在常温下是无色液体,密度是2.18g/cm ,沸点是131.4℃,熔点是9.79℃,不溶于水,易溶于醇、丙酮等有机溶剂。在实验室中可以用下图所示装置来制备1,2-二溴乙烷。其中试管c中装有液溴(表面覆盖少量水)。
,沸点是131.4℃,熔点是9.79℃,不溶于水,易溶于醇、丙酮等有机溶剂。在实验室中可以用下图所示装置来制备1,2-二溴乙烷。其中试管c中装有液溴(表面覆盖少量水)。
(1)写出制备1,2-二溴乙烷的化学方程式________。
(2)安全瓶a可以防止倒吸,并可以检查实验进行时试管c中导管是否发生堵塞。如果发生堵塞,a中的现象是__________。
(3)容器b中NaOH溶液的作用是__________,容器d中NaOH溶液的作用是__________。
(4)试管c浸入冷水中,以及液溴表面覆盖少量水的原因是__________。
(5)某同学在做实验时,使用一定量的液溴,当溴全部褪色时,通入的乙烯混合气体的量比正常情况下超出许多。如果装置的气密性没有问题,试分析可能的原因________________.
某课外小组设计的实验室制取乙酸乙酯的装置如图所示,A中放有浓硫酸,B中放有乙醇、无水醋酸钠,D中放有饱和碳酸钠溶液。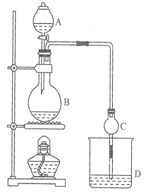
已知:①无水氯化钙可与乙醇形成难溶于水的CaCl2·6C2H5OH
②有关有机物的沸点:
| 试剂 |
乙醚 |
乙醇 |
乙酸 |
乙酸乙酯 |
| 沸点/℃ |
34.7 |
78.5 |
118 |
77.1 |
请回答:
(1)浓硫酸的作用:________________;若用同位素18O示踪法确定反应产物水分子中氧原子的提供者,写出能表示18O位置的化学方程式:
(2)球形干燥管C的作用是 反应前向D中加入几滴酚酞,反应结束后D中的现象是 。
(3)从D中分离出的乙酸乙酯中常含有一定量的乙醇、乙醚和水,应先加入无水氯化钙,分离出____________;再加入(此空从下列选项中选择)_________;然后进行蒸馏,收集77℃左右的馏分,以得到较纯净的乙酸乙酯:
A.五氧化二磷 B.碱石灰 C.无水硫酸钠 D.生石灰
某化学小组采用类似制乙酸乙酯的装置(如下图),以环己醇制备环己烯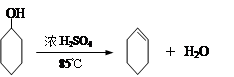
| |
密度 (g/cm3) |
熔点 (℃) |
沸点 (℃) |
溶解性 |
| 环己醇 |
0.96 |
25 |
161 |
能溶于水 |
| 环己烯 |
0.81 |
-103 |
83 |
难溶于水 |
(1)制备粗品
将12.5mL环己醇加入试管A中,再加入lmL浓硫酸,摇匀后放入碎瓷片,缓慢加热 至反应完全,在试管C内得到环己烯粗品。
①A中碎瓷片的作用是____________,导管B除了导气外还具有的作用是____________。
②试管C置于冰水浴中的目的是 。
(2)制备精品
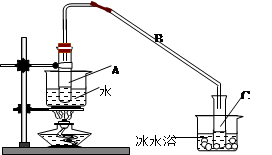
①环己烯粗品中含有环己醇和少量酸性杂质等。加入饱和食盐水,振荡、静置、分层,环己烯在_________层(填上或下),分液后用_________ (填入编号)洗涤。
A.KMnO4溶液 B.稀H2SO4 C.Na2CO3溶液
②再将环己烯按下图装置蒸馏,冷却水从_________口进入。蒸馏时要加入生石灰,目的是_____________。
③收集产品时,控制的温度应在_________左右,实验制得的环己烯精品质量低于理论产量,可能的原因是( )
A.蒸馏时从70℃开始收集产品
B.环己醇实际用量多了
C.制备粗品时环己醇随产品一起蒸出
(3)以下区分环己烯精品和粗品的方法,合理的是_________。
A.用酸性高锰酸钾溶液 B.用金属钠 C.测定沸点
肉桂酸是一种香料,具有很好的保香作用,通常作为配香原料,可使主香料的香气更加清香。实验室制备肉桂酸的化学方程式为: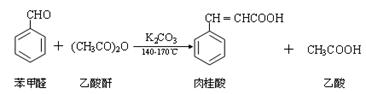
主要试剂及其物理性质
| 名称 |
分子量 |
性状 |
密度g/cm3 |
熔点℃ |
沸点℃ |
溶解度:克/100ml溶剂 |
||
| 水 |
醇 |
醚 |
||||||
| 苯甲醛 |
106 |
无色液体 |
1.06 |
-26 |
178-179 |
0.3 |
互溶 |
互溶 |
| 乙酸酐 |
102 |
无色液体 |
1.082 |
-73 |
138-140 |
12 |
溶 |
不溶 |
| 肉桂酸 |
148 |
无色结晶 |
1.248 |
133-134 |
300 |
0.04 |
24 |
溶 |
密度:常压,25℃测定主要实验步骤和装置如下: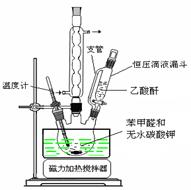
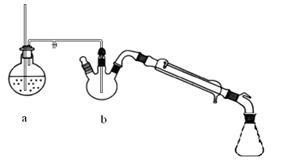
图1 制备肉桂酸的反应装置图 图2水蒸气蒸馏装置图
Ⅰ合成:按图1连接仪器,加入5mL苯甲醛、14mL乙酸酐和7.02g无水碳酸钾。在140~170℃,将此混合物回流45min。
Ⅱ分离与提纯:
①将上述合成的产品冷却后边搅拌边加入40ml水浸泡5分钟,并用水蒸气蒸馏,从混合物中除去未反应的苯甲醛,得到粗产品
②将上述粗产品冷却后加入40ml 10%的氢氧化钠水溶液,再加90ml水,加热活性炭脱色,趁热过滤、冷却;
③将1:1的盐酸在搅拌下加入到肉桂酸盐溶液中,至溶液呈酸性,经冷却、减压过滤、洗涤、干燥等操作得到较纯净的肉桂酸;
水蒸气蒸馏:使有机物可在较低的温度下从混合物中蒸馏出来,可以避免在常压下蒸馏时所造成的损失,提高分离提纯的效率。同时在操作和装置方面也较减压蒸馏简便一些,所以水蒸气蒸馏可以应用于分离和提纯有机物。回答下列问题:
(1)合成肉桂酸的实验需在无水条件下进行,实验前仪器必须干燥。实验中为控制温度在140~170℃需在 中加热(请从下列选项中选择)。
A.水 B.甘油(沸点290℃) C. 砂子 D.植物油(沸点230~325℃)
反应刚开始时,会有乙酸酐(有毒)挥发,所以该实验应在 中进行操作。
(2)图2中水蒸气蒸馏后产品在 (填仪器名称)
(3)趁热过滤的目的 ,方法: 。
(4)加入1:1的盐酸的目的是 ,析出的肉桂酸晶体通过减压过滤与母液分离。下列说法正确的是 。
A.选择减压过滤是因为过滤速度快而且能得到较干燥的晶体
B.放入比布氏漏斗内径小的滤纸后,直接用倾析法转移溶液和沉淀,再迅速开大水龙头抽滤
C.洗涤产物时,先关小水龙头,用冷水缓慢淋洗
D.抽滤完毕时,应先断开抽气泵和吸滤瓶之间的橡皮管,再关水龙头
(5)5mL苯甲醛、14mL乙酸酐和7.02g无水碳酸钾充分反应得到肉桂酸实际3.1g,则产率是 (保留3位有效数字)。
中国石油天然气勘探开发公司位于尼日尔的分支机构CNPC—尼日尔石油公司,日前在该国东部最新发现了2900万桶的石油储量,勘探小组在石油样品中发现一种烃的含氧衍生物。可用下图所示装置确定其分子式和其组成。(不考虑空气进入装置)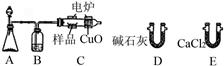
回答下列问题:
(1)A中发生反应的化学方程式为 。
(2)B装置的作用是 ,燃烧管C中CuO的作用是 。
(3)产生氧气按从左向右流向,燃烧管C与装置D、E连接。现甲、乙两位同学提出了两种连接方案。
方案1 甲同学认为连接顺序是:C→E→D
方案2 乙同学认为连接顺序是:C→D→E
请你评价两种连接方案,判断哪种方案正确并说明理由。
, 。
(4)准确称取1.8g烃的含氧衍生物X的样品,经充分燃烧后,D管质量增加2.64g,E管质量增加1.08g,实验测得X的蒸气密度是同温同压下氢气密度的45倍,则X的分子式为 ,1molX分别与足量Na、NaHCO3反应放出的气体在相同条件下的体积比为1∶1,X可能的结构简式为 。
阿司匹林可由水杨酸与乙酸酐作用制得。其制备原理如下:
主反应: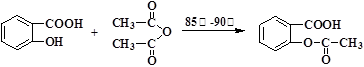 +化合物A
+化合物A
水杨酸 乙酸酐 阿司匹林(乙酰水杨酸)
副反应: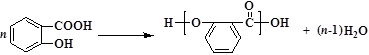
聚水杨酸
已知:① 水杨酸可溶于水,乙酰水杨酸的钠盐易溶于水,聚水杨酸(固体)难溶于水;
② 阿司匹林,白色针状或板状结晶或粉末,微溶于水;阿司匹林可按如下步骤制取和纯化:
步骤1:在干燥的50 mL圆底烧瓶中加入2 g水杨酸、5 mL乙酸酐和5滴浓硫酸,振荡使水杨酸全部溶解;
步骤2:按图所示装置装配好仪器,通水,在水浴上加热5~10min,用电炉控制温度在85~90℃;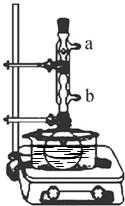
步骤3:反应结束后,取下反应瓶,冷却,再放入冰水中冷却、结晶、过滤、冷水洗涤2~3次,继续过滤得粗产物;
步骤4:将粗产物转移至150 mL烧杯中,在搅拌下加入25 mL饱和碳酸氢钠溶液,充分搅拌,然后过滤;
步骤5:将滤液倒入10 mL 4 mol/L盐酸溶液,搅拌,将烧杯置于冰浴中冷却,使结晶完全。过滤,再用冷水洗涤2~3次。
(1) 主反应中,生成物中化合物A是____________;
(2) 步骤2组装仪器还需要一种玻璃仪器,名称是________,该仪器的位置如何摆放?____________________________;冷凝管的作用是_________,冷凝管通水,水应从______(填“a”或“b”)口进。
(3) 步骤4过滤得到的固体为________;
(4) 经过步骤5得到产物,发生反应的化学方程式为______________________;
(5) 最后得到的阿司匹林可能会有少量未反应的水杨酸。如何用实验的方法检验步骤5中得到的晶体是否含有水杨酸?___________________________________。若阿司匹林晶体含有水杨酸,还需要采用________方法,进一步纯化晶体。
醇脱水是合成烯烃的常用方法,实验室合成环己烯的反应和实验装置如下:
可能用到的有关数据如下:
合成反应:在a中加入20g环己醇和2小片碎瓷片,冷却搅动下慢慢加入1mL浓硫酸,b中通入冷却水后,开始缓慢加热a,控制馏出物的温度不超过90℃。
分离提纯:
反应粗产物倒入分液漏斗中分别用少量5%碳酸钠溶液和水洗涤,分离后加入无水氯化钙颗粒,静置一段时间后弃去氯化钙,最终通过蒸馏得到纯净环己烯10g。
回答下列问题:
(1)装置b的名称是 。
(2)加入碎瓷片的作用是 ;如果加热一段时间后发现忘记加瓷片,应该采取的正确操作是 (填正确答案标号)。
A.立即补加 B. 重新配料 C.不需补加 D.冷却后补加
(3)分液漏斗在使用前须清洗干净并 ;在本实验分离过程中,产物应该从分液漏斗的
(填“上口倒出”或“下口倒出”)。
(4)分离提纯过程中加入无水氯化钙的目的是 。
(5)在环己烯粗产物蒸馏过程中,不可能用到的仪器有 (填正确答案标号)。
A.圆底烧瓶 B.温度计 C.吸滤瓶 D.冷凝管 E.接收器
(6)本实验所得到的环己烯产率是 _(填正确答案标号)。
A.41% B.50% C.61% D.70%
实验室用燃烧法测定某种氨基酸(CxHyOzNp)的分子组成。取Wg该种氨基酸放在纯氧气中充分燃烧,生成CO2、H2O和N2。现按图示装置进行实验:
请回答下列有关问题:
(1)实验开始时,首先要通入一段时间的氧气,其理由是
(2)以上装置中需要加热的仪器有 (用字母填空,下同)操作时应先点燃 处的酒精灯。
(3)A装置中发生反应的化学方程式是
(4)装置D的作用是
(5)读取N2体积时,应注意:
①
②
(6)实验中测得N2的体积为VmL(已折算为标准状况)。为确定此氨基酸的分子式,还需要的有关数据有______(用字母填空)。
| A.生成CO2气体的质量 | B.生成水的质量 |
| C.通入氧气的体积 | D.氨基酸的分子量 |
为了比较①H-OH,②CH3COOH,③CH3CH2—OH,④H2CO3,⑤苯酚五种物质分子中—OH上氢原子的活动性顺序,某课外活动小组设计了如下表所示的实验方案。请你利用有关实验仪器及给出的试剂,填写表中的空格,完成上述实验方案。可供选用的试剂有:紫色石蕊试液、金属钠、氢氧化钠溶液、碳酸钠溶液。实验中所需仪器自选。
| 实验步骤和操作 |
实验现象 |
结论(-OH上氢原子活动性顺序) |
| (1).五种物质各取少量于五支试管中,各加入紫色石蕊试液2~3滴 |
②、④变红,其它不变 |
②、④>①、③、⑤ |
| (2). |
|
|
| (3).①、③、⑤各取少量于试管中,各加入少量NaOH溶液 |
⑤由浑浊变澄清 |
⑤>①、③ |
| (4). |
|
|
(5).通过以上实验比较,从而得出这五种物质分子中—OH上氢原子的活动性由强到弱的顺序为(填序号) 。
试题篮
()