水中的溶解氧是水生生物生存不可缺少的条件。某课外小组采用碘量法测定学校周边河水中的溶解氧。实验步骤及测定原理如下:
Ⅰ.取样、氧的固定
用溶解氧瓶采集水样。记录大气压及水体温度。将水样与 碱性悬浊液(含有 )混合,反应生成 ,实现氧的固定。
Ⅱ.酸化、滴定
将固氧后的水样酸化, 被 还原为 ,在暗处静置 ,然后用标准 溶液滴定生成的 ( )。
回答下列问题:
(1)取水样时应尽量避免扰动水体表面,这样操作的主要目的是_____________。
(2)"氧的固定"中发生反应的化学方程式为_______________。
(3) 溶液不稳定,使用前需标定。配制该溶液时需要的玻璃仪器有烧杯、玻璃棒、试剂瓶和____________;蒸馏水必须经过煮沸、冷却后才能使用,其目的是杀菌、除____及二氧化碳。
(4)取 水样经固氧、酸化后,用 溶液滴定,以淀粉溶液作指示剂,终点现象为________________;若消耗 溶液的体积为 ,则水样中溶解氧的含量为_________mg·L − 1。
(5)上述滴定完成时,若滴定管尖嘴处留有气泡会导致测量结果偏___________。(填"高"或"低")
在苹果、香蕉等水果的果香中存在着乙酸正丁酯。某化学课外兴趣小组欲以乙酸和正丁醇为原料合成乙酸正丁酯。实验步骤如下:
(一)乙酸正丁酯的制备
①在干燥的50mL圆底烧瓶中,加入13.5mL(0.15mol)正丁醇和7.2mL(0.125mol)冰醋酸,再加入3~4滴浓硫酸,摇匀,投入1~2粒沸石。
按下图所示安装带分水器的回流反应装置,并在分水器中预先加入水,使水面略低于分水器的支管口。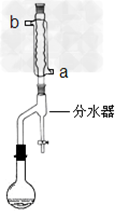
②打开冷凝水,圆底烧瓶在石棉网上用小火加热。在反应过程中,通过分水器下部的旋塞不断分出生成的水,注意保持分水器中水层液面原来的高度,使油层尽量回到圆底烧瓶中。反应达到终点后,停止加热,记录分出的水的体积。
(二)产品的精制
③将分水器分出的酯层和反应液一起倒入分液漏斗中,先用10 mL的水洗涤,
再继续用10 mL10%Na2CO3洗涤至中性,再用10 mL 的水洗涤,最后将
有机层转移至锥形瓶中,再用无水硫酸镁干燥。
④将干燥后的乙酸正丁酯滤入50 mL 烧瓶中,常压蒸馏,收集124~126℃的
馏分,得11.6g产品。
(1)写出该制备反应的化学方程式_______________。
(2)冷水应该从冷凝管___________(填a或b)管口通入。
(3)步骤②中不断从分水器下部分出生成的水的目的是__________________。步骤②中判断反应终点的依据是_______。
(4)产品的精制过程步骤③中,洗的目的是______________________。两次洗涤完成后将有机层从分液漏斗的__________置入锥形瓶中。
红葡萄酒密封储存时间越长,质量越好,原因之一是储存过程中生成了有香味的酯。在实验室也可以用如下图所示的装置制取乙酸乙酯,请回答下列问题。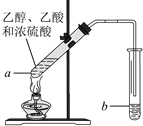
(1)乙醇分子官能团名称是_______________。
(2)试管A中加入几块碎瓷片的目的是___________。
(3)试管A中发生反应的化学方程式为 ___________,反应类型是_______。
(4)反应开始前,试管B中盛放的溶液是____________。作用是___________。
(5)可用_________的方法把制得的乙酸乙酯分离出来。
乙醇氧化后可生成乙醛,某研究性学习小组的同学通过查阅资料获得信息:
①乙醛的沸点是20.8℃,它在溶液中易被氧化,氧化产物的沸点是117.9℃;
②久置的乙醛水溶液会产生分层现象,下层为水溶液,上层无色油状液体为乙醛的环状聚合物(C2H4O)n,该聚合物的沸点比水的沸点高,分子中无醛基;
③利用反应:(C2H4O)n nC2H4O △H<0,可从久置的乙醛水溶液中提取乙醛(仍得到乙醛的水溶液)。
nC2H4O △H<0,可从久置的乙醛水溶液中提取乙醛(仍得到乙醛的水溶液)。
根据上述信息,用如图装置提取乙醛,请回答下列问题:
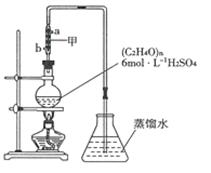
(1)写出乙醇氧化成乙醛的化学方程式: ;
(2)将混合物加热至沸腾,(C2H4O)n缓缓分解,把生成的气体导入锥形瓶中:
①若实验过程中不使用冷凝管冷却,随着蒸发的进行,溶液中有黑色物质和刺激性气味气体生成。用化学方程式表示这一现象: ;
②当锥形瓶内导管口气泡越来越少时,表明大部分乙醛已蒸出,实验结束。拆除实验装置的第一步操作是: ;
(3)当n=3时,试写出(C2H4O)n的结构简式 ;
(4)设计一简单实验证明久置的乙醛是否被氧化(写出简要操作步骤、使用的试剂、实验现象和结论): 。
下面是某化学学习小组的同学进行研究性学习的过程,请你参与并协助他们完成相关学习任务。
I.课本介绍了乙醇氧化的实验:把一端弯成螺旋状的铜丝放在酒精灯外焰加热,待铜丝表面变黑后立即把它插入盛有约2 mL乙醇的试管里,反复操作几次。注意闻生成物的气味,并观察铜丝表面的变化。
(1)小赵同学用化学方法替代“闻生成物的气味”来说明生成物的出现,该化学方法中所另加的试剂及出现的主要现象是 (用所学的知识回答)。
(2)小赵同学在探究“闻生成物的气味”的替代方法时,偶然发现向溴水中加入足量的乙醛溶液,可以看到溴水褪色。该同学为解释上述现象,提出三种猜想:
①溴与乙醛发生取代反应;
② ;
③由于醛基具有还原性,溴将乙醛氧化为乙酸。
为探究哪种猜想正确,小李同学提出了如下两种实验方案:
方案一:用pH试纸检测溴水褪色后溶液的酸碱性;
方案二:测定反应前溴水中Br2的物质的量和反应后溶液中Br— 的物质的量。
(3)方案一是否可行 (填“是”或“否”),理由是 。
(4)小李同学认为:假设测得反应前溴水中Br2的物质的量为amol,若测得反应后n(Br— )= mol,则说明溴与乙醛发生取代反应。
(5)小吴同学设计如下实验方案:
①按物质的量之比为1:5配制KBrO3—KBr溶液,加合适的适量的酸,完全反应并稀至1L,生成0.5molBr2。
②取上述溶液10mL加入足量乙醛溶液,使之褪色,然后将所得溶液稀释为100mL,准确量取其中10mL。
③加入过量的AgNO3溶液,过滤、洗涤、干燥后称量得到淡黄色固体0.188g。
试通过计算判断:溴与乙醛发生反应的化学方程式为 。
Ⅱ.小刘同学在查阅资料时得知,乙醛在氧化铜催化剂存在的条件下,可以被空气氧化成乙酸。依据此原理设计实验并在试管C中收集到少量乙酸溶液(如图所示:试管A中装有40%的乙醛水溶液、氧化铜粉末;试管C中装有适量蒸馏水;烧杯B中装有某液体)。已知在60℃~80℃时用双连打气球鼓入空气即可发生乙醛的氧化反应,连续鼓入十几次反应基本完全。有关物质的沸点见下表:
| 物质 |
乙醛 |
乙酸 |
甘油 |
乙二醇 |
水 |
| 沸点 |
20.8℃ |
117.9℃ |
290℃ |
197.2℃ |
100℃ |
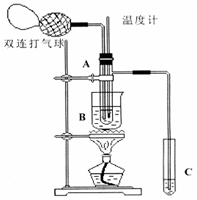
请回答下列问题:
(1)试管A内在60℃~80℃时发生的主要反应的化学方程式为(注明反应条件) 。
(2)如图所示在实验的不同阶段,需要调整温度计在试管A内的位置,在实验开始时温度计水银球的位置应在 ;目的是 ;当试管A内的主要反应完成后温度计水银球的位置应在 ,目的是 。
(3)烧杯B内盛装的液体可以是 (写出一种即可,在题给物质中找)。
已知:有机物A的产量可以用来衡量一个国家的石油化工发展水平。现以A为主要原料合成乙酸乙酯,其合成路线如下图所示。
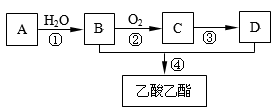
(1)A分子中官能团的名称是 ,反应①的化学反应类型是 反应。
(2)反应④的化学方程式是 。
(3)某同学用如图所示的实验装置制取少量乙酸乙酯。
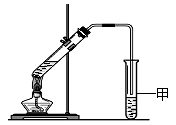
实验结束后,试管甲中上层为透明的、不溶于水的油状液体。
①实验开始时,试管甲中的导管不伸入液面下的原因是 。
②若分离出试管甲中该油状液体需要用到的仪器是________(填序号)。
a.漏斗 b.分液漏斗 c.长颈漏斗
③实验结束后,若振荡试管甲,会有无色气泡生成,其主要原因是 (结合化学方程式回答)。
有机物A可由葡萄糖发酵得到,也可从酸牛奶中提取。纯净的A为无色粘稠液体,易溶于水。为研究A的组成与结构,进行了如下实验:
| 实 验 步 骤 |
解 释 或 实 验 结 论 |
| (1)称取A 9.0g,升温使其汽化,测其密度是相同条件下H2的45倍。 |
试通过计算填空: (1)A的相对分子质量为: 。 |
| (2)将此9.0gA在足量纯O2充分燃烧,并使其产物依次缓缓通过浓硫酸、碱石灰,发现两者分别增重5.4g和13.2g。 |
(2)A的分子式为: 。 |
| (3)另取A 9.0g,跟足量的NaHCO3粉末反应,生成2.24LCO2(标准状况),若与足量金属钠反应则生成2.24LH2(标准状况)。 |
(3)用结构简式表示A中含有的官能团: ___________。 |
| (3)另取A 9.0g,跟足量的NaHCO3粉末反应,生成2.24LCO2(标准状况),若与足量金属钠反应则生成2.24LH2(标准状况)。 |
(3)用结构简式表示A中含有的官能团:____________。 |
(4)A的核磁共振氢谱如下图: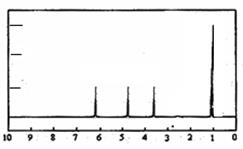 |
(4)A中含有______种氢原子。 |
| (5)综上所述,A的结构简式 。 |
化学上常用燃烧法确定有机物的组成.下图装置是用燃烧法确定有机物化学式常用的装置,这种方法是在电炉加热时用纯氧氧化管内样品.根据产物的质量确定有机物的组成.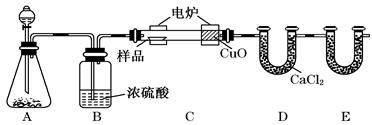
回答下列问题:
(1)A装置中分液漏斗盛放的物质是_________,写出有关反应的化学方程式__________.
(2)C装置(燃烧管)中CuO的作用是______________________________________
(3)写出E装置中所盛放试剂的名称__________,它的作用是______________.
(4)若将B装置去掉会对实验造成什么影响?__________________________.有学生认为在E后应再加一与E相同的装置,目的时_______________________
(5)若准确称取1.20 g样品(只含C、H、O三种元素中的两种或三种).经充分燃烧后,E管质量增加1.76 g,D管质量增加0.72 g,则该有机物的最简式为______________.
(6)要确定该有机物的化学式,还需要测定________________________.
通常用燃烧的方法测定有机物的分子式,可在燃烧室内将有机物样品与纯氧在电炉加热下充分燃烧,根据产品的的质量确定有机物的组成。下图所示的是用燃烧法确定有机物分子式的常用装置。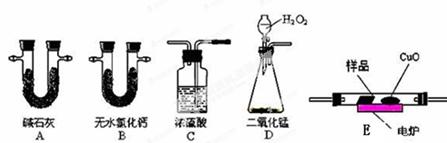
现准确称取4.4 g样品(只含C、H、O三种元素中的两种或三种),经燃烧后A管增重8.8 g,B管增重3.6g。请回答:
(1)C管中浓硫酸的作用是________________________________________;
(2)按上述所给的测量信息,装置的连接顺序应是:_______________(每种装置只用一次);
(3)要确定该有机物的分子式,还必须知道的数据是_________________;
①C装置增加的质量
②样品的摩尔质量
③CuO固体减少的质量
(4)相同条件下,若该有机物蒸气对氢气的相对分子质量为22,且它的核磁共振氢谱上有两个峰,其强度比为3:1,试通过计算确定该有机物的结构简式 ,与该有机物相对分子质量相同的烃的一氯代物有 种。
B.【实验化学】塑化剂DBP(邻苯二甲酸二丁酯)主要应用于PVC等合成材料中作软化剂。
合成反应原理为:

实验步骤如下:
步骤1 在三口烧瓶中放入14.8g邻苯二甲酸酐、25mL正丁醇、4滴浓硫酸,开动搅拌器(反应装置如图)。

步骤2 缓缓加热至邻苯二甲酸酐固体消失,升温至沸腾。
步骤3 等酯化到一定程度时,升温至150℃
步骤4 冷却,倒入分漏斗中,用饱和食盐水和5%碳酸钠洗涤。
步骤5 减压蒸馏,收集200~210℃2666Pa馏分,即得DBP产品
(1)搅拌器的作用 。
(2)图中仪器a名称及作用是 ;步骤3中确定有大量酯生成的依据是 。
(3)用饱和食盐水代替水洗涤的好处是 。
(4)碳酸钠溶液洗涤的目的是 。
(5)用减压蒸馏的目的是 。
(本题共12分)乙酸正丁酯常用作香精,实验室用冰醋酸和正丁醇制备乙酸正丁酯
Ⅰ.乙酸正丁酯粗产品的制备
试管中加少许入沸石、7.4 mL正丁醇和6.4 mL冰醋酸,再加入3~4滴浓硫酸,然后安装好装置,加热使之反应。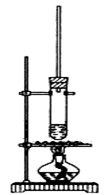
Ⅱ.乙酸正丁酯粗产品的精制
将试管中的液体转移到分液漏斗中,用10 mL水洗涤,除去下层水层;有机层继续用10 mL 10% Na2CO3洗涤至中性;再用10 mL 的水洗涤。
将酯层进行蒸馏。蒸馏收集乙酸正丁酯产品时,应将温度控制在126.1℃左右。
Ⅲ.计算产率
称量出制得的乙酸正丁酯的质量为5. 12 g。
已知:
| 物质 |
密度/g·cm-3 |
沸点/℃ |
溶解度/100g水 |
| 正丁醇 |
0.810 |
118.0 |
9 |
| 冰醋酸 |
1.049 |
118.1 |
互溶 |
| 乙酸正丁酯 |
0.882 |
126.1 |
0.7 |
完成下列填空: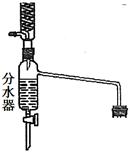
(1)上图装置中长导管有冷凝回流作用,它可以由分水回流装置代替。分水回流装置中回流下来的蒸气冷凝液进入分水器,待分层后,有机层会自动流回到反应器中,将生成的水从分水器中放出去。
分水回流代替长导管回流,对乙酸正丁酯的合成有什么作用 。
使用分水器装置进行回流的可逆反应,一般应具备 条件。
(2)分水器在使用时须预先加水,使其水面低于分水器回流支管下沿3~5 mm的水。
预先加水的目的是 。
(3)反应时加热有利于 提高酯的产率,但温度过高时酯的产率反而降低,
其可能的原因是 。
(4)水洗的目的是 。碱洗的目的是 。
测pH值的操作 。
(5)本次实验乙酸正丁酯的产率 。
常见的一硝基甲苯有对硝基甲苯和邻硝基甲苯两种,均可用于合成各种染料。某探究小组利用下列反应和装置制备一硝基甲苯。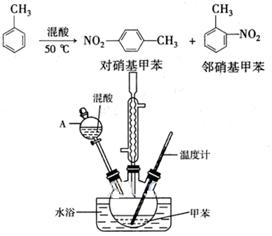
实验中可能用到的数据: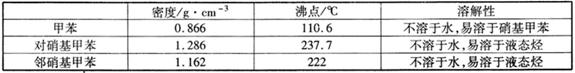
实验步骤:①按体积比1:3配制浓硫酸与浓硝酸混合物40 mL;
②在三颈瓶中加入15 mL(13g)甲苯,按图所示装好药品和其他仪器;
③向三颈瓶中加入混酸,并不断搅拌(磁力搅拌器已略去);
④控制温度约为50℃,反应大约10 min,三颈瓶底有大量淡黄色油状液体出现;
⑤分离出一硝基甲苯的总质量13.60 g。
请回答下列问题:
配制混酸的方法是_____ ___。
反应中需不断搅拌,目的是_________________________________________________。
(2)仪器A的名称是________,使用该仪器前必须进行的操作是_________。
(3)若实验后在三颈瓶中收集到的产物较少,可能的原因是_________。
(4)分离反应后产物的方案如下:
其中,操作1的名称为________,操作2中需要使用下列仪器中的________(填序号)。
a.冷凝管
b.酒精灯
c.温度计
d.分液漏斗
e.蒸发皿
(5)该实验中一硝基甲苯的产率为________(保留两位有效数字)。
(14分)芳香族羧酸通常用芳香烃的氧化来制备。芳香烃的苯环比较稳定,难于氧化,而环上的支链不论长短,在强烈氧化时,最终都氧化成羧基。某同学用甲苯的氧化反应制备苯甲酸。
反应原理: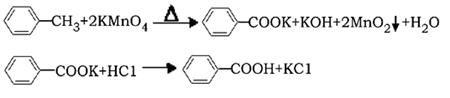
反应试剂、产物的物理常数:
| 名称 |
相对分 子质量 |
性状 |
熔点 |
沸点 |
密度 |
溶解度 |
||
| 水 |
乙醇 |
乙醚 |
||||||
| 甲苯 |
92 |
无色液体易燃易挥发 |
-95 |
110.6 |
0.8669 |
不溶 |
易溶 |
易溶 |
| 苯甲酸 |
122 |
白色片状或针状晶体 |
122.4 |
248 |
1.2659 |
微溶 |
易溶 |
易溶 |
主要实验装置和流程如下:
实验方法:一定量的甲苯和KMnO4溶液置于图1装置中,在90℃时, 反应一段时间,再停止反应,按如下流程分离出苯甲酸和回收未反应的甲苯。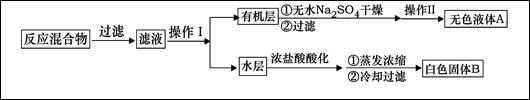
(1)无色液体A的结构简式为 。操作Ⅱ为 。
(2)如果滤液呈紫色,要先加亚硫酸氢钾,然后再加入浓盐酸酸化,加亚硫酸氢钾的目的是 。
(3)下列关于仪器的组装或者使用正确的是 。
A.抽滤可以加快过滤速度,得到较干燥的沉淀
B.安装电动搅拌器时,搅拌器下端不能与三颈烧瓶底、温度计等接触
C.图1回流搅拌装置应采用直接加热的方法
D.冷凝管中水的流向是下进上出
(4)除去残留在苯甲酸中的甲苯应先加入 ,分液,水层再加入 ,然后抽滤,干燥即可得到苯甲酸。
(5)纯度测定:称取1.220g产品,配成100mL溶液,取其中25.00mL溶液,进行滴定 ,消耗KOH物质的量为2.4×10-3mol。产品中苯甲酸质量分数为 。
(15分)实验室用少量的溴和足量的乙醇制备1,2—二溴乙烷的装置如下图所示(加热及夹持装置省略):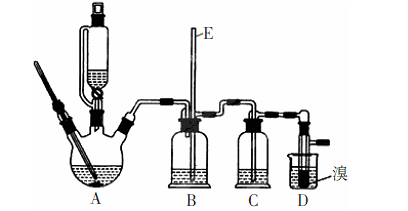
制备1,2--溴乙烷可能存在的主要副反应有:乙醇在浓硫酸的存在下在140℃脱水生成乙醚。有关数据列表如下: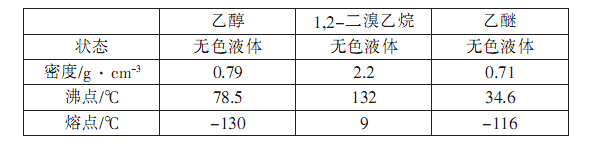
回答下列问题:
(1)装置A、D中发生主要反应的化学方程式为: ; 。
(2)装置B中长玻璃管E的作用: 。
(3)在此制备实验中,要尽可能迅速地把反应温度提高到170℃左右,其最主要目的是 ;(填正确选项前的字母)
a.引发反应 b.加快反应速度
c.防止乙醇挥发 d.减少副产物乙醚生成
(4)在装置C中应加入____,其目的是完全吸收反应中可能生成的酸性气体:(填正确选项前的字母)
a.水 b.浓硫酸
c.氢氧化钠溶液 d.酸性KMnO4溶液
(5)反应过程中应用冷水冷却装置D.其主要目的是: ;但又不能过度:冷却(如用冰水),其原因是: ;将1,2-二溴乙烷粗产品置于分液漏斗中加水,振荡后静置,产物应在 层(填“上”、“下”)。
对叔丁基苯酚 工业用途广泛,可用于生产油溶性酚醛树脂、稳定剂和香料等。实验室以苯酚、叔丁基氯[(CH3)3CCl]等为原料制备对叔丁基苯酚。实验步骤如下:反应物和产物的相关数据列表如下:
工业用途广泛,可用于生产油溶性酚醛树脂、稳定剂和香料等。实验室以苯酚、叔丁基氯[(CH3)3CCl]等为原料制备对叔丁基苯酚。实验步骤如下:反应物和产物的相关数据列表如下:
步骤l:组装仪器,用量筒量取2.2 mL叔丁基氯(过量),称取1.6 g苯酚,搅拌使苯酚完全溶解,并装入滴液漏斗。
步骤2:向X中加入少量无水AlCl3固体作催化剂,打开滴液漏斗旋塞,迅速有气体放出。
步骤3:反应缓和后,向X中加入8 mL水和1 mL浓盐酸,即有白色固体析出。
步骤4:抽滤得到白色固体,洗涤,得到粗产物,用石油醚重结晶,得对叔丁基苯酚1.8 g。
(1)仪器X的名称为 。
(2)步骤2中发生主要反应的化学方程式为 。该反应过于激烈,放出大量热,常使实验的产率降低,可能的原因是 。
(3)图中倒扣漏斗的作用是 。苯酚有腐蚀性,能使蛋白质变性,若其溶液沾到皮肤上可用 洗涤。
(4)在取用苯酚时发现苯酚冻结在试剂瓶中,可采取的措施为____ 。
(5)下列仪器在使用前必须检查是否漏液的是 (填选项字母)。
| A.量筒 |
| B.容量瓶 |
| C.滴定管 |
| D.分液漏斗 |
E.长颈漏斗
(6)本实验中,对叔丁基苯酚的产率为 。(请保留三位有效数字)
试题篮
()