在某100ml的混合液中,硝酸和硫酸的物质量浓度分别是0.4mol/L,0.1mol/L,向该混合液中加入1.92g铜粉,加热,待充分反应后,所得溶液中铜离子物质量浓度是(mol/L):
A 0.15 B 0.225
C 0.35 D 0.45
在室温下,将PH=3的酸和PH=11的碱等体积混合,混合后溶液的PH小于7。则该酸和碱的组合可以是( )
| A.硝酸和氢氧化钠 | B.盐酸和氨水 |
| C.硫酸和氢氧化钾 | D.醋酸和氢氧化钡 |
下列各组混合气体分别通入水中,其中一种气体消失,另一种气体体积增大的是(双选)…( )
| A.HCl、CO2 | B.O2、F2 | C.NO、NO2 | D.H2S、SO2 |
有五瓶溶液分别是①10mL0.60mol·L-1NaOH水溶液②20mL0.5mol·L-1H2SO4水溶液③30mL0.40mol·L-1HCl水溶液④40mL0.30mol·L-1HCl水溶液⑤50mL0.20mol·L-1蔗糖水溶液。以上各瓶溶液所含离子、分子总数大小顺序是……( )
| A.①>②>③>④>⑤ | B.②>①>③>④>⑤ |
| C.②>③>④>①>⑤ | D.⑤>④>③>②>① |
在一密闭容器中CO、H2、O2共16.5 g,用电火花引燃,使其完全燃烧,再将燃烧后的气体用Na2O2充分吸收,Na2O2增重7.5 g,则原混合气体中O2的质量分数是( )
| A.36% | B.54.5% | C.40% | D.33.3% |
下列有关水的说法正确的是:
| A.单质与水反应时,水不做氧化剂,就做还原剂。 |
| B.盐一定能促进水电离。 |
| C.金属的电化腐蚀一定与水有关。 |
| D.酸性氧化物均能与水反应生成含氧酸。 |
向20mL盐酸和硫酸的混合酸溶液中,渐渐加入
0.1mol/L的Ba(OH)2溶液。生成沉淀的质量和溶液的pH变化曲线如右图。根据此实验数据计算:
(1)原溶液中硫酸和盐酸的浓度各为多少_________________。
(2)A点处溶液的pH是______________。
A、B、C是在中学化学中常见的3种化合物,它们各由两种元素组成,甲、乙是两种单质,这些化合物和单质之间存在如下的关系:
单质甲  化合物A
化合物A 化合物B
化合物B  化合物B
化合物B
化合物A和化合物C 单质乙和化合物C
据此判断:
(1)在A、B、C这3种化合物中,必定含有乙元素的是 (用A、B、C字母填写)
(2)单质乙必定是 (填“金属”或“非金属”),其理由是 。
(3)单质乙的分子式可能是 ,则化合物B的分子式是
下列氧化物按其形成的含氧酸酸性递增顺序排列的是
| A.SiO2<CO2<SO3<P2O5 | B.SiO2<CO2<P2O5<SO3 |
| C.CO2<SiO2<P2O5<SO3 | D.CO2<P2O5<SO3<SiO2 |
下列A ~ I九种物质之间的转化关系如图所示;其中部分生成物或反应条件已略去。已知A为固态单质,常温下C、E、F都是无色气体。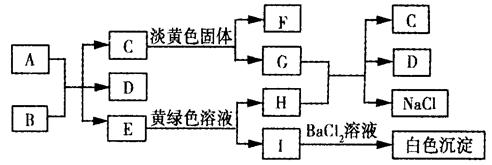
请填空:
(1)C的固体属于_____晶体,F的化学式(分子式)是________。
(2)A与B反应的化学方程式是: 。
(3)G与H反应的离子方程式是 ,
E转变为H和I的离子方程式是 。
某化学兴趣小组的同学为模拟工业制造硫酸的生产过程,设计了如图所示的装置,请根据要求回答问题:
(1)装置A用来制取氧气,写出相应的化学方程式__________________________;
(2)燃烧炉内放一定量黄铁矿粉末,在高温条件下和A装置制出的氧气充分反应,其化学方程式为 ,在该反应中____________做氧化剂;若消耗了
,在该反应中____________做氧化剂;若消耗了 有_______________mol电子发生了转移;
有_______________mol电子发生了转移;
(3)C装置为净化装置,若无该装置,将混合气体直接通入D装置,除对设备有腐蚀外,还会造成的后果是_______________________________________________;
(4)如果D装置的温度是400℃~500℃,在常压下生成 ,可放出
,可放出 的热量,请写出该反应的热化学方程式________________________________________;并回答在工业中不采取加压措施的原因_ ____________________________。
的热量,请写出该反应的热化学方程式________________________________________;并回答在工业中不采取加压措施的原因_ ____________________________。
对三硫化四磷分子的结构研究表明,该分子中没有不饱和键,且各原子的最外层均已达到了 8 个电子的结构。则一个三硫化四磷分子中含有的共价键个数是
| A.7 个 | B.9 个 | C.19 个 | D.不能确定 |
VL含有(NH4)2SO4、NH4NO3的混合溶液,加入a mol NaOH后,加热,恰好使NH3全部逸出;又加入b mol BaCl2则刚好使SO42-完全沉淀,则原混合溶液中NH4NO3的物质的量浓度为( )
A.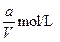 |
B. |
C.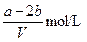 |
D. |
 已知周期表中,元素
已知周期表中,元素、
、
、
与元素
相邻。
的最高化合价氧化物的水化物是强酸。回答下列问题:
 (1)
(1)与
可以形成一种高温结构陶瓷材料。
的氯化物分子呈正四面体结构,
的氧化物的晶体类型是;
 (2)
(2)的具有相同化合价且可以相互转变的氧化物是;
 (3)
(3)和
形成的二价化合物中,
呈现最高化合价的化合物是化学式是;
 (4)这5个元素的氢化物分子中,①立体结构类型相同的氢化物的沸点从高到低排列次序是(填化学式),其原因是
(4)这5个元素的氢化物分子中,①立体结构类型相同的氢化物的沸点从高到低排列次序是(填化学式),其原因是 ②电子总数相同的氢化物的化学式和立体结构分别是
②电子总数相同的氢化物的化学式和立体结构分别是
 (5)
(5)和
所形成的结构陶瓷材料的一种合成方法如下:
的氯化物与
的氢化物加热反应,生成化合物
和
气体;
在高温下分解生成
的氢化物和该陶瓷材料。上述相关反应的化学方程式(各物质用化学式表示)是

开发新材料是现代科技发展的方向之一。下列有关材料的说法正确的是()
| A. | 氮化硅陶瓷是新型无机非金属材料 |
| B. |
|
| C. | 纤维素乙酸酯属于天然高分子材料 |
| D. | 单晶硅常用于制造光导纤维 |
试题篮
()