现有部分短周期元素的性质或原子结构如下表:
| 元素编号 |
元素性质或原子结构 |
| T |
所有元素中电负性最大的元素 |
| X |
L层p电子数比s电子数多2个 |
| Y |
其最高价氧化物呈两性 |
| Z |
L层有三个未成对电子 |
(1)写出元素X电子排布式 。
(2)Z原子共有 种运动状态不同的电子。
(3)写出Z元素形成的单质的结构式: 。
(4)元素T与氯元素相比,非金属性较强的是 (用元素符号表示),下列表述 中能证明这一事实的是
A、常温下氯气的颜色比T单质的颜色深
B、T的单质通入氯化钠水溶液不能置换出氯气
C、氯与T形成的化合物中氯元素呈正价态
(5)探寻物质的性质差异性是学习的重要方法之—。T、X、Y、Z四种元素的单质中化学性质明显不同于其他三种单质的是 (填化学式),理由 。
(6)T与Z形成的化合物含有的化学键类型 。
A~H均为短周期元素,A~F在元素周期表中的相对位置如图所示,G与其它七种元素不在同一周期,H是短周期中原子半径最大的主族元素。由B、G组成的气态化合物甲水溶液呈碱性。
| A |
B |
C |
|
| D |
|
E |
F |
请回答下列问题:
(1)写出甲的电子式 ,实验室制取气体甲的化学方程式为 。
(2)B、C、G个数比为1:1:5形成的化合物的化学键类型为 。
A.离子键 B. 极性键 C. 非极性键
(3)请用电子式表示AE2的形成过程 。
(4)用离子符号表示C、E、F、H四种离子的半径由大到小的顺序 。
(5)用一个离子方程式解释A比D非金属性强的原因 。
下表为周期表的一部分,其中的编号代表对应的元素。
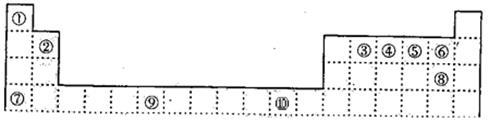
(1)⑨是 (填元素名称)。
(2)画出⑥的离子结构示意图 。
(3)元素⑦和⑧形成的化合物属于 晶体,它比NaF的熔点 (填“高”或“低”)。
(4)在 ①~⑩ 元素的最高价氧化物的水化物碱性最强的是 ,酸性最强的是 。(填化学式)
(5)⑧形成的最高价氧化物化学式是 。
(6)元素⑩在元素周期表的 族,其原子的外围电子排布式 。
(7)第四周期所有元素的基态原子中,4p轨道半充满的是 (请填元素符号,下同),4s轨道半充满的是 。
下图是元素周期表的一部分,表中的①~⑩中元素,用元素符号或化学式填空回答:
 族 族周期 |
ⅠA |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
0 |
| 二 |
|
|
|
|
① |
|
② |
|
| 三 |
③ |
④ |
⑤ |
⑥ |
|
|
⑦ |
⑧ |
| 四 |
⑨ |
|
|
|
|
|
⑩ |
|
(1)在这些元素中,化学性质最活泼的非金属原子的原子结构示意图为 。
(2)地壳中含量最多的金属元素是 (写元素符号) 。
(3)这些元素中的最高价氧化物对应的水化物中,酸性最强的是 ,碱性最强的是 ,呈两性的氢氧化物是 。
(4)写出⑤与氢氧化钠反应的化学方程式: ,
写出⑤的氢氧化物与氢氧化钠溶液完全反应的离子方程式:
X、Y、Z、Q、E五种元素中,X原子核外的M层中只有两对成对电子,Y原子核外的L层电子数是K层的两倍,Z是地壳内含量(质量分数)最高的元素,Q的核电荷数是X与Z的核电荷数之和,E在元素周期表的各元素中电负性最大。请回答下列问题:
(1)X、Y的元素符号依次为 、 ;
(2)XZ2与YZ2分子的立体结构分别是 和 ,相同条件下两者在水中的溶解度较大的是 (写分子式),理由是 ;
(3)Q的元素符号是 ,它属于第 周期,它的核外电子排布式为 ,在形成化合物时它的最高化合价为 ;
(4)用氢键表示式写出E的氢化物溶液中存在的所有氢键 。
现有A、B、C、D、E五种原子序数依次增加的短周期元素,其中A的最低负价和最高正价代数和为零,且A2常温下为气态,B与其他元素形成的化合物种类最多,C与E可形成EC2和EC3两种物质,D是短周期最活泼的金属元素,用化学用语回答下列问题:
(1)D离子结构示意图_________________,B在元素周期表的位置_______________;
(2)A与C形成含18个电子的化合物的电子式是_______________;
(3)C与D形成的一种化合物颜色为淡黄色,其阴阳离子个数比为_____________,含有的化学键类型为___________;
(4)C、D、E的常见离子的离子半径由大到小的顺序__________________;
(5)B、E两元素得电子能力B________E(填“>”或“<”),试写出证明该结论的一个化学方程式_______;
(6)工业上常用氨水吸收尾气中的EC2,离子方程式为_______________________。
下表是元素周期表中的一部分。

根据A—J在周期表中的位置,用元素符号或化学式回答下列问题:
(1)化学性质最不活泼的元素是 ,氧化性最强的单质是 ,还原性最强的单质是 。
(2)最高价氧化物对应的水化物中,碱性最强的是 ,酸性最强的是 ,呈两性的是 。
(3)A分别与E、F、G、H、I形成的化合物中,最稳定的是 。
(4)在B、C、D、G、I中,原子半径最大的是 。
(5)元素C与I形成的化合物的电子式是 。
a、b、c、d代表四种短周期主族元素。已知:a、b、c同周期,且原子序数之和为22;元素b的最简单氢化物与元素a的氢化物可化合生成离子化合物M;d是短周期中金属性最强的元素.b的最高和最低化合价的代数和为2。
请回答下列问题:
(1)a、b、c的元素符号依次为_______、_______、_______。d在氧气中燃烧产物的电子式为 。
(2) 三种常见离子,在化合物M的水溶液中不能大量存在的是 (填离子符号)。
三种常见离子,在化合物M的水溶液中不能大量存在的是 (填离子符号)。
(3)元素e为a的同主族短周期元素,e的单质可与水反应,写出反应的离子方程式:______________
(4)c的一种氢化物的相对分子质量为78,是英国科学家法拉第在1825年首先发现的,分子中两种元素的原子个数比为1:1,该氢化物的分子中有 个原子共平面,写出该氢化物与e的单质在氯化铁催化作用下发生取代反应的化学方程式:____ 。
随着原子序数的递增,八种短周期元素原子半径的相对大小和最高正价或最低负价如图所示。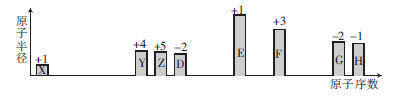
(1)元素Z位于元素周期表的第__________周期___________族,X与Z可形成18电子的化合物,该化合物的电子式为_______________。
(2)非金属性:Y___________(填“>”“<”或“=”)D。
(3)单质F与EDX溶液反应的化学化学方程式为____________________。
(4)G和H可形成一种化合物,其相对分子质量在90~110之间。且G的质量分数约为31.1%,该化合物的化学式为_________。
[化学—物质结构与性质]
A、B、C、D、E五种元素中,A原子核外的M层中只有两对成对电子,B原子核外的L层电子数是K层的两倍,C是地壳内含量(质量分数)最高的元素,D的核电荷数是A与C的核电荷数之和,E在元素周期表的各元素中电负性最大。请回答下列问题:
(1)A、B的元素符号依次为_____________、_______________;
(2)AC2与BC2分子的立体结构分别是______和______,相同条件下两者在水中的溶解度较大的是______(写分子式),理由是___________________________________________;
(3)D的核外电子排布式为________________________,在形成化合物时它的最高化合价为__________。
(8分) 元素及其化合物的知识是高中化学重要的组成部分,是考查化学基本概念和理论、化学计算、化学实验知识的载体。
(1)元素周期表1-20号元素中,某两种元素的原子序数相差3,周期数相差1。
①这样的两种元素的组合有________种。
②若这样的两种元素形成的化合物中原子数之比为1∶1。
写出其中一种化合物的名称:_____________;
(2)A是自然界存在最广泛的ⅡA族元素,常以化合物F存在.从单质A起始发生的一系列化学反应可由下图表示:
请回答下列问题:
①F的化学式为_______ _,D的电子式为________________。
②E与水反应的化学方程式为_____________________;
③实际生产中,可由F为原料制备单质A,写出制备过程的化学方程式(不需考虑综合经济效益) 。
现有属于前四周期的A、B、C、D、E、F、G七种元素,原子序数依次增大。A元素的价电子构型为nsnnpn+1;C元素为最活泼的非金属元素,D元素核外有三个电子层,最外层电子数是核外电子总数的1/6;E元素正三价离子的3d轨道为半充满状态,F元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子;G元素与A元素位于同一主族,其某种氧化物有剧毒。
(1)A元素的第一电离能 B元素的第一电离能(填“<”“>”或“=”),A、B、C三种元素电负性由小到大的顺序为 (用元素符号表示)。
(2)D元素原子的价电子排布式是 。
(3)C元素的电子排布图为 ;E3+的离子符号为 。
(4)F元素位于元素周期表的 区,其基态原子的电子排布式为 。
(5)G元素可能的性质 。
A.其单质可作为半导体材料
B.其电负性大于磷
C.最高价氧化物对应的水化物是强酸
有A、B、C、D、E五种单核微粒:①当A微粒失去3个电子后,电子层结构与氖原子的相同;②B微粒得到一个电子后,其电子层结构与氩原子相同;③C微粒带两个单位正电荷,核电荷数为12;④D微粒18个电子。带两个单位的负电荷;⑤E微粒不带电,原子核中只有一个质子。请回答:
(1)写出各微粒的符号:A_______、B_______、C_______、D_______、E_______。
(2)B微粒的结构示意图是_______,D微粒的结构示意图是_______。
(12分)A、B、C、D、E、F为核电荷数依次增大且均小于18的同周期元素。已知A、C、F三原子的最外电子层共有11个电子,且这三种元素的最高价氧化物对应的水化物之间两两皆能反应,均生成盐和水。D元素原子的最外层电子数比次外层少4个,E元素原子次外层电子数比最外层电子数多3个。试回答:
(1)写出元素符号:A________,D________,E________。
(2)用电子式表示B与F形成化合物的过程:___________________________________。
(3)A、C两元素的最高价氧化物对应水化物相互反应的离子方程式为:_____________________。
(4)D的固态氧化物为________。
A、B、C、D、E、F六种短周期元素,它们的原子序数依次增大。A与D同主族;C与E同主族;B、C同周期;B原子最外层电子数比其次外层电子数多2;B、A两元素的核电荷数之差等于它们的原子最外层电子数之和;F元素是同周期元素中原子半径最小的主族元素。A、B、C、D、E、F形成的化合物甲、乙、丙、丁、戊、己的组成如下表所示。
| 化合物 |
甲 |
乙 |
丙 |
丁 |
戊 |
己 |
| 化学式 |
A2C |
A2C2 |
B2A2 |
D2C2 |
A2E |
DF |
回答下列问题
(1)元素B的元素符号是: 化合物丙的电子式为 。化合物丁存在的化学键类型是 。
(2)化合物甲的沸点比戊 (填“高”或“低”),B、C、D原子半径从大到小依次为 (用元素符号)
(3)向含有0.2 mol乙的水溶液中加入少量MnO2,使乙完全反应,发生转移的电子数为 NA (NA代表阿伏加德罗常数)
(4)A单质与C单质在KOH溶液中可以组成燃料电池,则正极附近溶液的pH将 ;放电一段时间KOH的物质的量 (填“变大”“变小”“不变”)
(5)用电子式表示己的形成过程: 。
试题篮
()