有一种瓦斯分析仪能够在煤矿巷道中的甲烷达到一定浓度时,通过传感器显示出来。该瓦斯分析仪工作原理类似燃料电池的工作原理,其装置如下图所示,其中的固体电解质是Y2O3-Na2O,O2-可以在
其中自由移动。下列有关叙述正确的是
| A.电极a是正极,电极反应式为CH4+4O2--8e-=CO2+2H2O |
| B.电极b是正极,O2-由电极b流向电极a |
| C.瓦斯分析仪工作时,电池内电路中电子由电极a流向电极b |
| D.当电路中有0.4mol电子转移时,a极有2.24L(标况)甲烷放电 |
镁—次氯酸盐燃料电池,它具有比能量高、安全方便等优点。该电池的正极反应式为:ClO-+ H2O + 2e-= Cl-+ 2OH-,关于该电池的叙述正确的是
| A.该电池中镁为负极,发生还原反应 |
| B.电池工作时,OH-向正极移动 |
| C.该电池的总反应为:Mg + ClO-+ H2O = Mg(OH)2↓+ Cl- |
| D.电池工作时,正极周围溶液的pH将不断变小 |
高温钠硫电池是一种新型可充电电池,其工作原理如图所示,图中固体电解质是Na+导体。下列叙述正确的是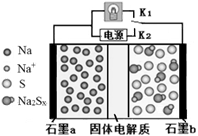
| A.放电时,石墨电极a为正极 |
| B.放电时,Na+从石墨b向石墨a方向迁移 |
| C.充电时,b极反应为Na2Sx -2e- = xS+2Na+ |
| D.可将装置中的固体电解质改成NaCl溶液 |
大功率的镍氢电池使用在油电混合动力车辆中。镍氢电池NiMH电池正极板材料为NiOOH,负极板材料为吸氢合金,下列关于该电池的说法中正确的的是
| A.放电时电池内部H+向负极移动 |
| B.充电时,将电池的负极与外接电源的正极相连 |
| C.充电时阳极反应为Ni(OH)2+ OH-- e-=NiOOH+H2O |
| D.放电时负极的电极反应式为MHn-ne-= M+nH+ |
一种新型的乙醇电池,它用磺酸类质子溶剂。电池总反应为:C2H5OH+3O2=2CO2+3H2O,电池示意如图,下列说法正确的是
| A.A处通氧气,B处通乙醇 |
| B.电池工作时电流由b极沿导线经灯泡再到a极 |
| C.电池正极的电极反应为:O2+2H2O+4e-=4OH- |
| D.若用这种电池作电源保护金属铁,则a电极连接石墨,b连接铁 |
一种新型的乙醇电池,它用磺酸类质子溶剂。电池总反应为:C2H5OH +3O2→ 2CO2 +3H2O,电池示意如下图,下列说法正确的是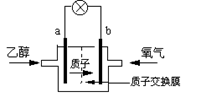
| A.a极为电池的正极 |
| B.电池工作时电流由a极沿导线经灯泡再到b极 |
| C.电池负极的电极反应为:4H+ + O2 + 4e-= 2H2O |
| D.电池工作时,1mol C2H5OH被氧化时有12mol e-转移 |
中国首个空间实验室—“天宫一号”的供电系统中有再生氢氧燃料电池(RFC),它是一种将水电解技术与氢氧燃料电池技术相结合的可充电电池。下图为RFC工作原理示意图,a、b、c、d均为Pt电极。下列说法正确的是
A、B区的OH-通过隔膜向a电极移动,A区pH增大
B、图中右管中的OH-通过隔膜向c电极移动,d电极上发生还原反应
C、c是正极,电极上的电极反应为: 2H++2e-=H2↑
D、当有1 mol电子转移时,b电极产生气体Y的体积为11.2 L
LED产品的使用为城市增添色彩。下图是氢氧燃料电池驱动LED发光的一种装置示意图。下列有关叙述正确的是
| A.b处通入H2 |
| B.该装置将化学能最终转化为电能 |
| C.通入H2的电极发生反应:2H2 - 4e-= 4H+ |
| D.a处为电池负极,发生了氧化反应 |
铅蓄电池的两极分别为Pb、PbO2,电解质溶液为H2SO4,工作时的反应为
Pb+PbO2+2H2SO4=2PbSO4+2H2O,下列结论正确的是
| A.Pb为正极被氧化 |
| B.溶液的pH不断减小 |
| C.放电时负极反应式是PbO2 +4H++ SO42-+2e-= PbSO4 +2H2O |
| D.溶液pH不断增大 |
微型钮扣电池在现代生活中有广泛应用。有一种银锌电池,其电极分别是Ag2O和Zn,电解质溶液为KOH,负极反应为:Zn+2OH--—2e-==ZnO+H2O;正极反应为:Ag2O+H2O+2e-==2Ag+2OH-,根据反应式,判断下列叙述正确的是
| A.在使用过程中,电池正极区溶液的pH增大 |
| B.使用过程中,电子由Ag2O极经外电路流向Zn极 |
| C.Zn是正极,Ag2O是负极 |
| D.Zn电极发生还原反应,Ag2O电极发生氧化反应 |
(共10分前2个空每空一个1分,其余每空2分)依据氧化还原反应2Ag+(aq)+Cu(s) ="===" Cu2+(aq)+2Ag(s)设计的原电池如图所示:
请回答下列问题:
(1)外电路中的电子是从_______ 电极流向________电极。
(2)银电极发生的电极反应为________________________;
X电极上发生的电极反应为___________________________;
(3)LiSOCl2电池可用于心脏起搏器。该电池的电极材料分别为锂和碳,电解液是LiAlCl4-SOCl2。电池的总反应可表示为4Li+2SOCl2==="4LiCl" +S +SO2↑。请回答下列问题:
写出电池的负极发生的电极反应为_________________________________________;
电池正极发生的电极反应为______________________________________;
某固体酸燃料电池以CaHSO4固体为电解质传递H+,其基本结构见下图,电池总反应可表示为:2H2+O2===2H2O,下列有关说法正确的是
| A.电子通过外电路从b极流向a极 |
| B.b极上的电极反应式为O2+2H2O+4e-===4OH- |
| C.每转移0.2 mol电子,消耗标准状况下1.12 L的H2 |
| D.H+由a极通过固体酸电解质传递到b极 |
镁燃料电池在可移动电子设备电源和备用电源等方面应用前景广阔。如图为“镁一次氯酸盐”燃料电池示意图,电极为镁合金和铂合金。关于该电池的叙述正确的是
| A.E为该燃料电池的正极 |
| B.负极发生的电极反应式为ClO—+2e—+H2O=Cl—+2OH— |
| C.电池工作时,正极周围溶液的pH将不断变小 |
| D.镁燃料电池负极能发生自腐蚀产生氢气,使负极利用率降低 |
在下列各反应的离子方程式书写中,正确的是
| A.将Na2O2放入水中发生的反应:Na2O2+2H2O=2Na++2OH-+O2↑ |
| B.除去CuSO4溶液中的Fe3+:2 Fe3++3Cu=2Fe+3Cu2+ |
| C.在KOH溶液中,甲烷-氧气燃料电池放电时的反应:CH4+2O2+2OH-=CO32-+ 3H2O |
D.电解饱和食盐水制备H2和Cl2:2Cl-+2H+ Cl2↑+H2↑ Cl2↑+H2↑ |
试题篮
()