高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压。高铁电池的总反应为:3Zn+2K2FeO4+8H2O 3Zn(OH)2+2Fe(OH)3+4KOH。下列叙述不正确的是
3Zn(OH)2+2Fe(OH)3+4KOH。下列叙述不正确的是
| A.放电时负极反应为:3Zn-6e-+6OH-====3Zn(OH)2 |
B.充电时阳极反应为:Fe(OH)3-3e-+5OH- FeO42- +4H2O FeO42- +4H2O |
| C.放电时每转移3 mol电子,正极有1 mol K2FeO4被还原 |
| D.充电时阴极溶液的碱性减弱 |
蓄电池在放电时起原电池作用,在充电时起电解池的作用。下式是爱迪生蓄电池分别在充电和放电时的反应:Fe+NiO2+2H2O Fe(OH)2+Ni(OH)2,
Fe(OH)2+Ni(OH)2,
则下列有关对爱迪生蓄电池的推断错误的是
| A.放电时正极附近pH增大 |
| B.充电时阴极的电极反应式为:Fe(OH)2 +2e-=Fe+2OH- |
| C.放电时电解质溶液中的阴离子向正极方向移动 |
| D.蓄电池的电极可浸入某种碱性电解质溶液中 |
熔融碳酸盐燃料电池,是由多孔陶瓷阴极、多孔陶瓷电解质隔膜、多孔金属阳极、金属极板构成的燃料电池。其电解质是熔融态碳酸盐。下图是用熔融碳酸盐作电解质,氢气和氧气形成的燃料电池;下列说法正确的是:
| A.该电池放电时,负极的反应式为:H2 - 2e-+CO2 =H2O+ CO32- |
| B.该电池中CO32-的为由左边移向右边移动 |
| C.该电池放电时,正极的反应式为:O2 +2CO2+ 4e- =2CO32- |
| D.该电池放电时,当转移4mol e-时正极消耗1mol O2和1mol CO2 |
铁镍蓄电池又称爱迪生电池,放电时的总反应为:Fe+Ni2O3+3H2O= Fe(OH)2+2Ni(OH)2
下列有关该电池的说法不正确的是
| A.电池的电解液为碱性溶液,正极为Ni2O3、负极为Fe |
| B.电池放电时,负极反应为Fe+2OH−−2e−=Fe(OH)2 |
| C.电池充电过程中,阴极附近溶液的pH降低 |
| D.电池充电时,阳极反应为2Ni(OH)2+2OH−−2e−=Ni2O3+3H2O |
钠硫电池以熔融金属钠、熔融硫和多硫化钠(Na2Sx)分别作为两个电极的反应物,固体Al2O3陶瓷(可传导Na+)为电解质,其反应原理如下图所示:
下列说法不正确的是
| A.放电时,电极A为负极 |
| B.根据上表数据,该电池工作的适宜温度应控制在350~2050℃ |
| C.充电时,Na+的移动方向为从电极B到电极A |
| D.充电时,总反应为Na2Sx==2Na+xS(3<x<5),则阳极的电极反应式为Sx-2e-==xS |
常用的电池是一个液体电解质将两个固体电极隔开。而钠-硫(Na/S8)电池正相反,它是由固体电解质将两个液体电极隔开(如图),一个由钠-β-氧化铝固体电解质做成的中心管,将内室的熔融钠(熔点98℃)和外室的熔融硫(熔点119℃)隔开,并允许Na+通过。下列有关说法不正确的是
| A.a为电池的正极 |
| B.充电时b接电源的正极 |
| C.正极反应为:nS8+16ne-=8Sn2- |
| D.Na+可以穿过固体电解质从而传递电流 |
已知外电路中,电子由铜流向a极。有关下图所示装置的分析中,合理的一项是
| A.一段时间后Zn电极逐渐溶解 |
| B.该装置中Cu极为正极,发生还原反应 |
| C.b极反应的电极反应式为:H2-2e-=2H+ |
D.电流方向: |
一种使用阴离子交换膜(只也许阴离子通过)的铜锌电池结构结构如下图:

以下选项两栏内容正确且相关联的是
| 选项 |
操作与现象 |
解释与推论 |
| A |
电池放电时化学能转化为电能 |
Zn(s)+ Cu2+(aq)= Zn2+ + Cu(s) △H>0 |
| B |
该电池充电时铜棒变细 |
两电极区溶液颜色都变深 |
| C |
该电池放电时铜棒是电池正极 |
Cl-通过交换膜从左(铜棒区)向右(锌棒区)移动 |
| D |
该电池充电时a接电源正极 |
电极反应Cu2++2e- = Cu |
随着各地“限牌”政策的推出,电动汽车成为汽车届的“新宠”。特斯拉全电动汽车使用的是钴酸锂(LiCoO2)电池,其工作原理如右图,A 极材料是金属锂和碳的复合材料(碳作为金属锂的载体),电解质为一种能传导Li+的高分子材料,隔膜只允许特定的离子通过,电池反应式LixC6+Li1-xCoO2 C6+LiCoO2。下列说法不正确的是
C6+LiCoO2。下列说法不正确的是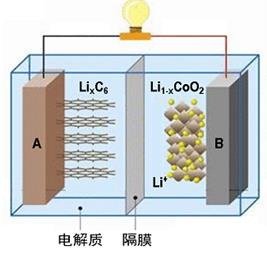
| A.据题意分析可知该隔膜只允许Li+通过,放电时Li+从左边流向右边 |
| B.放电时,正极锂的化合价未发生改变 |
| C.充电时B作阳极,该电极放电时的电极反应式为:Li1-x CoO2+ xLi++ xe-= LiCoO2 |
| D.废旧钴酸锂(LiCoO2)电池进行“放电处理”让Li+进入石墨中而有利于回收 |
用吸附了氢气的纳米碳管等材料制作的二次电池的原理如图所示。下列说法正确的是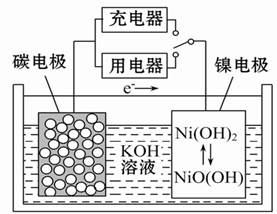
| A.放电时,OH-向镍电极作定向移动 |
| B.放电时,负极的电极反应为:H2-2e-+2OH-="==" 2H2O |
| C.充电时,将电池的碳电极与外电源的正极相连 |
| D.充电时,阴极的电极反应为:Ni(OH)2+OH--e-===NiO(OH)+H2O |
液流电池是一种新的蓄电池,是利用正负极电解液分开,各自循环的一种高性能蓄电池,具有容量高、使用领域(环境)广、循环使用寿命长的特点。如图是一种锌溴液流电池,电解液为溴化锌的水溶液。下列说法正确的是
A.充电时阳极的电极反应式:Zn-2e- Zn2+ Zn2+ |
| B.充电时电极a为外接电源的负极 |
| C.放电时Br-向右侧电极移动 |
| D.放电时左右两侧电解质储罐中的离子总浓度均增大 |
利用人工模拟光合作用合成甲酸的原理为:
2CO2+2H2O 2HCOOH+O2,装置如图所示,
2HCOOH+O2,装置如图所示,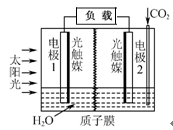
下列说法不正确的是
| A.电极1周围pH增大 |
| B.电子由电极1经过负载流向电极2 |
| C.电极2的反应式:CO2+2H++2e-=HCOOH |
| D.该装置能将太阳能转化为化学能和电能 |
磷酸燃料电池是目前较为成熟的燃料电池之一,其基本组成及反应原理如下图所示。下列说法不正确的是
| A.该系统中不只存在化学能和电能的相互转化 |
B.在移位反应器中,反应CO(g)+H2O(g)  CO2(g)+H2(g)(ΔH>0),若温度越高,则v(CO)越大 CO2(g)+H2(g)(ΔH>0),若温度越高,则v(CO)越大 |
| C.改质器和移位反应器的作用是将CxHy转化为H2和CO2 |
| D.该电池正极的电极反应为O2+4H+—4e-===2H2O |
某科研小组成功研制出能在“数分钟之内”将电量充满的锂电池,其成本只有传统锂电池的一半。他们把锂锰氧化物(LMO)浸泡在石墨里面,使其变成一个可以导电的密集网络的负极材料,与电 解质和正极材料(石墨)构成可充电电池。若电解液为LiAlCl4-SOCl2,电池的总反应为:
4LiCl+S+SO2 4Li+2SOCl2
4Li+2SOCl2
下列说法正确的是
| A.电池的电解液可为LiCl水溶液 |
| B.放电时负极反应式为:Li-e-+ Cl-=LiCl |
| C.放电时正极反应式为: 2SOCl2+4e-=4Cl-+S+SO2 |
| D.放电时电子从负极经外电路流向正极,再从正极经电解质流向负极 |
试题篮
()