以下有水参与的化学反应都属于氧化还原反应,但水既不做氧化剂又不做还原剂的有 。
①2Na2O2+2H2O=4NaOH+O2↑ ②Cl2+H2O="HCl+HClO "
③C+H2O=CO+H2 ④3NO2+H2O=2HNO3+NO
⑤2Na+2H2O=2NaOH+H2↑ ⑥2F2+2H2O=4HF+O2
有a、b、c、d四种金属,将a与b用导线连结起来浸入某电解质溶液中,b不易腐蚀。将a、d分别投入等浓度的盐酸中,d比a反应剧烈。将Cu浸入b的盐溶液里,无明显变化。如果把Cu浸入c的盐溶液里,有c的单质析出,据此判断它们的活动性由强到弱的顺序( )
| A.d、a、b、c | B.b、a、d、c | C.d、b、a、c | D.d、c、a、b |
(1)下列反应中都有水参加:
| A.Cl2+ H2O +Na2SO3="=" 2HCl + Na2SO4 |
| B.3NO2 + H2O ="=" 2HNO3 + NO↑ |
| C.NaH +H2O ="=" NaOH + H2↑ |
| D.2H2O 电解2H2↑+ O2↑ |
其中,水只是氧化剂的是 ,水既不是氧化剂又不是还原剂的是 ,(各1分)
(2)在3BrF3+5H2O=9HF+HBrO3+O2↑+Br2反应中,若有5.4gH2O被氧化,
则被还原的BrF3共 mol,其中被水还原的BrF3是 mol。(各2分)
某反应中反应物与生成物有: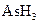 、
、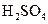 、
、 、
、 、
、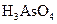 、Br2和。
、Br2和。
(1)配平上述化学反应方程式并标出电子转移的方向和数目: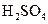 +
+ +
+ 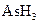 →
→ 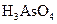 + Br2 +
+ Br2 +  + H2O
+ H2O
(2)反应中,被还原的元素是 ,还原剂是 。
(3)根据上述反应可推知 。
a.氧化性: b.氧化性:
b.氧化性:
c.还原性: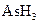 >Br2 d.还原性:
>Br2 d.还原性: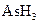 > Br2
> Br2
根据反应式:①2Fe3++2I- 2Fe2++I2和② Br2+2Fe2+
2Fe2++I2和② Br2+2Fe2+ 2Fe3++ 2Br-,可判断离子的还原性从强到弱的顺序是
2Fe3++ 2Br-,可判断离子的还原性从强到弱的顺序是
| A.Br-、Fe2+、I- | B.I-、Fe2+、Br- |
| C.Br-、I-、Fe2+ | D.Fe2+、I-、Br- |
常温下,分别在溶液中发生如下反应:(1)16H+ + 10Z- + 2XO4- ="=" 2X2++ 5Z2↑+ 8H2O,(2)2A2+ + B2==2A3++ 2B-,(3)2B- + Z2== B2 + 2Z-。由此判断下列说法错误的是
| A.反应Z2+2A2+="=" 2A3++2Z-能发生 |
| B.氧化性由强到弱的顺序是XO4-、Z2、B2、A3+ |
| C.还原性由强到弱的顺序是 A 2+、B-、Z-、X2+ |
| D.Z元素在(1)、(3)反应中均被还原 |
下列说法中,不正确的是
| A.利用铁加入硫酸铜溶液中的反应不可以比较Cu、Fe2+的还原性: |
| B.足量的铜跟一定量的浓硝酸反应只产生一种气体 |
| C.氮的固定不一定只有在高温、高压、催化剂的条件下才能实现 |
| D.用苯萃取溴水中的Br2时,有机层从分液漏斗的下端放出 |
对反应14CuSO4+5FeS2+12H2O═7Cu2S+5FeSO4+12H2SO4的下列说法正确的是( )
| A.该反应的氧化剂只有CuSO4 |
| B.SO42﹣既不是氧化产物也不是还原产物 |
C.1molCuSO4氧化了 mol的S mol的S |
| D.被还原的S和被氧化的S的质量比为3:7 |
下列比较中,正确的是
| A.原子半径:Na>Mg | B.碱性:NaOH>KOH |
| C.结合H+的能力:CO32¯<Cl¯ | D.还原性:I¯<Br¯ |
已知在酸性溶液中的还原性强弱顺序为:SO2 > I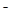 > H2O2 > Fe
> H2O2 > Fe > Cl
> Cl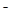 ,下列反应不可能发生的是
,下列反应不可能发生的是
A.2I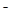 + Fe + Fe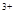 =I2 + Fe =I2 + Fe |
B.2Fe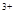 + SO2 + 2H2O=2Fe + SO2 + 2H2O=2Fe + SO + SO + 4H+ + 4H+ |
| C.SO2 + 2H2O + I2=H2SO4 + 2HI |
| D.H2O2 + H2SO4=SO2↑ + O2↑ + 2H2O |
实验室常用NaNO2和NH4Cl反应制取N2。下列有关说法正确的是( )
| A.NaNO2是还原剂 |
| B.NH4Cl中N元素被还原 |
| C.生成1 mol N2时转移6 mol 电子 |
| D.氧化剂和还原剂的物质的量之比是1︰1 |
试题篮
()