为验证氧化性Cl2>Fe3+>SO2,某小组用下图所示装置进行实验(夹持仪器和 A中加热装置已略,气密性已检验)。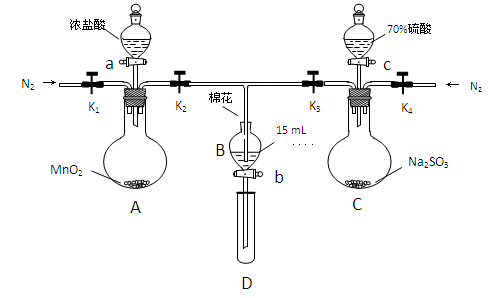
实验过程:
Ⅰ.打开弹簧夹K1~K4,通入一段时间N2,再将T型导管插入B中,继续通入N2,然后关闭K1、K3、K4。
Ⅱ.打开活塞a,滴加一定量的浓盐酸,给A加热。
Ⅲ.当B中溶液变黄时,停止加热,夹紧弹簧夹K2。
Ⅳ.打开活塞b,使约2mL的溶液流入D试管中,检验其中的离子。
Ⅴ.打开弹簧夹K3、活塞c,加入70%的硫酸,一段时间后夹紧弹簧夹K3。
Ⅵ.更新试管D,重复过程Ⅳ,检验B溶液中的离子。
(1)A中发生反应的化学方程式为 。
(2)用70%的硫酸制取SO2,反应速率比用98%的硫酸快,原因是 。
(3)甲、乙、丙三位同学分别完成了上述实验,他们的检测结果一定能够证明氧化性
Cl2>Fe3+>SO2的是 (填“甲”“乙”“丙”)。
| |
过程Ⅳ B溶液中含有的离子 |
过程Ⅵ B溶液中含有的离子 |
| 甲 |
有Fe3+无Fe2+ |
有SO42- |
| 乙 |
既有Fe3+又有Fe2+ |
有SO42- |
| 丙 |
有Fe3+无Fe2+ |
有Fe2+ |
(4)进行实验过程Ⅴ时,B中溶液颜色由黄色逐渐变为红棕色,停止通气,放置一段时间后溶液颜色变为浅绿色。
查阅资料:Fe2+(aq)+SO32-(aq) FeSO3(s)(墨绿色)
FeSO3(s)(墨绿色)
提出假设:FeCl3与 SO2的反应经历了中间产物FeSO3,溶液的红棕色是FeSO3(墨绿色)与FeCl3(黄色)的混合色。某同学设计如下实验,证实该假设成立: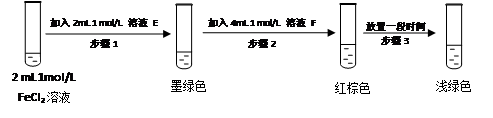
① 溶液E和F分别为 、 。
② 请用化学平衡原理解释步骤3中红棕色溶液颜色变为浅绿色的原因
。
Ⅰ.铁盐、亚铁盐是实验室常用的药品。
请根据题意,完成下列填空:
(1)向酸化的FeCl3溶液中逐滴加入KI溶液,溶液变成棕褐色。该反应的离子方程式为________________。
(2)向酸化的FeSO4溶液中加几滴硫氰化钾溶液,没有什么明显变化,再滴加双氧水,溶液变血红色。继续滴加双氧水,血红色逐渐褪去,且有气泡产生。
写出上述变化中,有关反应的离子方程式:
①____________________________________;
②Fe3++3SCN-=Fe(SCN)3;
③11H2O2+2SCN-=2SO42—+2CO2↑+N2↑+10H2O+2H+
若生成1 mol N2,H2O2和SCN-的反应中转移电子的物质的量是________ mol。
(3)根据以上实验,推断Fe2+、I-和SCN-的还原性由强到弱的顺序为________。
Ⅱ.某课题组利用Fe粉和KNO3溶液反应,模拟地下水脱氮过程,探究脱氮原理。
(4)实验前:①先用0.1 mol·L-1 H2SO4洗涤Fe粉,其目的是__________,然后用蒸馏水洗涤至中性;②将KNO3溶液的pH调至2.5;③为防止空气中的O2对脱氮的影响,应向KNO3溶液通入________(写化学式)。
(5)如图表示足量Fe粉还原上述KNO3溶液过程中,测出的溶液中相关离子浓度、pH随时间的变化关系(部分副反应产物曲线略去)。请根据图中信息写出t1时刻前该反应生成的阳离子分别是________、________。t1时刻后,该反应仍在进行,溶液中NH4+的浓度在增大,Fe2+的浓度却没有增大,可能的原因是__________________。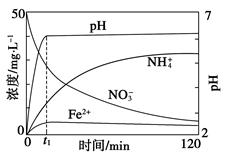
某化学小组在学习元素周期律知识后,对教材中Cl2将Fe2+氧化成Fe3+的实验进一步思考,并提出问题:Cl2能将Fe2+氧化成Fe3+,那么Br2和I2能否将Fe2+氧化成Fe3+?
环节一:理论推测。
部分同学认为Br2和I2都能将Fe2+氧化成Fe3+,依据是
____________________________________________。
部分同学认为Br2和I2都不能将Fe2+氧化成Fe3+。还有同学认为Br2能将
Fe2+氧化成Fe3+,而I2不能,依据是同一主族从上到下卤素单质的氧化性逐渐减弱。
环节二:设计实验进行验证。
向大试管中加入适量铁粉,加入10 mL稀盐酸,振荡试管,充分反应后,铁粉有剩余,取上层清液进行下列实验。
实验1:
| 试管 |
操作 |
现象 |
| ① |
先向试管中加入2 mL新制的FeCl2溶液,再向试管中滴加少量红棕色的溴水,振荡试管 |
溶液为黄色 |
| ② |
先向试管中加入2 mL新制的FeCl2溶液,再向试管中滴加少量棕黄色的碘水,振荡试管 |
溶液为黄色 |
环节三:实验现象的分析与解释。
(1)甲同学认为试管①中的现象说明溴水能将Fe2+氧化,反应的离子方程式为______________________________________________________。
乙同学认为应该补做实验,才能得出甲同学的结论。请你帮助乙同学完成实验:
实验2:
| 操作 |
现象 |
| |
|
(2)该小组同学对试管②中所得的溶液呈黄色的原因展开讨论,并提出了两种假设:
假设1:碘水与FeCl2溶液不反应,黄色是碘水稀释后的颜色。
假设2.________________。
实验3:进行实验以判断假设是否成立。
| 操作 |
现象 |
| 向试管②所得的溶液中继续加入0.5 mL CCl4,充分振荡,静置一段时间。取出上层溶液,滴加KSCN溶液 |
静置后,上层溶液几乎无色,下层溶液为紫色;取上层溶液滴加KSCN溶液后,溶液呈浅红色 |
丙同学认为实验3的现象可以说明假设2成立,丁同学认为不严谨,于是设计了实验4继续探究。
实验4:
| 操作 |
现象 |
| 向另一支试管中加入2 mL新制的FeCl2溶液,滴加0.5 mL碘水后,再加入0.5 mL乙酸乙酯,充分振荡,静置一段时间。取出下层溶液,滴加KSCN溶液 |
静置后,上层溶液为紫色,下层溶液几乎无色;取下层溶液,向其中滴加KSCN溶液后,溶液没有呈浅红色 |
你认为实验4中加入乙酸乙酯的主要目的是_____________________。
丁同学根据实验4的现象得出结论:在本次实验条件下,碘水与FeCl2溶液反应的程度很小。
(3)Cl2、Br2、I2氧化Fe2+的能力逐渐减弱,从原子结构角度解释原因:_____________________________________________。
对实验过程中出现的异常现象进行探究,是实施素质教育、培养创新精神的有效途经。
【实验1】用下图实验装置进行铜与浓硫酸的反应,实验中发现试管内除了产生白色硫酸铜固体外,在铜丝表面还有黑色固体甲生成,甲中可能含有黑色的CuO、CuS、Cu2S。查阅资料:CuS和Cu2S均为黑色固体,常温下都不溶于稀盐酸,在空气中煅烧,均转化为CuO和SO2。为了探究甲的成分,该小组同学在收集到足够量的固体甲后,进行了如下实验: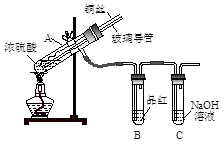

(1)上述实验装置除了有尾气吸收装置外,还有一个显著的优点是 。
(2)固体乙在空气中煅烧时,使用的实验仪器除了玻璃棒、三脚架、酒精灯外,还必须有 。
(3)确定乙是否煅烧完全的操作是 。
(4)煅烧过程中一定发生的化学反应方程式为 。
【实验2】某化学兴趣小组设计了如下实验装置(尾气吸收装置未画出),探究Cl2、Br2、Fe3+的氧化性强弱。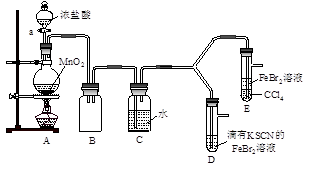
(5)根据下列实验操作和现象,填写实验结论。
| 实验操作 |
实验现象 |
结论 |
| 打开活塞a,向圆底烧瓶中滴入适量浓盐酸;然后关闭活塞a,点燃酒精灯。 |
D装置中:溶液变红 E装置中:水层溶液变黄, 振荡后,CCl4层无明显变化。 |
Cl2、Br2、Fe3+的氧化性由强到弱的顺序为: |
(6)因忙于观察和记录,没有及时停止反应,D、E中均发生了异常的变化:D装置中,红色慢慢褪去;E装置中,CCl4层先由无色变为橙色,后颜色逐渐加深,直至变成红色。
为探究上述实验现象的本质,小组同学查得资料如下:
| ⅰ.(SCN)2性质与卤素单质类似。氧化性:Cl2>(SCN)2。 ⅱ.Cl2和Br2反应生成的BrCl呈红色,沸点约5℃,与水发生水解反应。 ⅲ.AgClO、AgBrO均可溶于水。 |
①请用平衡移动原理(结合化学用语)解释Cl2过量时D中溶液红色褪去的原因____ ;
请设计简单实验证明上述解释 。
②欲探究E中颜色变化的原因,设计实验如下:用分液漏斗分离出E的下层溶液,蒸馏、收集红色物质,取少量,加入AgNO3溶液,结果观察到仅有白色沉淀产生。请结合化学用语解释仅产生白色沉淀的原因 。
下图为中学化学实验中的常见实验装置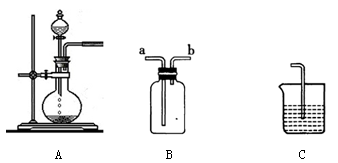
(1)装置A可用于制备多种气体,请写出用A装置制备下列气体时,圆底烧瓶和分液漏斗中应装的化学试剂
| 气体 |
O2 |
CO2 |
HCl |
| 试剂 |
|
|
|
(2)装置B可用于收集多种气体,若要用于收集Cl2,则进气管为________;若要收集CO,简述用装置B收集CO的方法________________________________
(3)现要用上述装置制取Cl2,并设计实验比较Cl2和I2的氧化性强弱,请在表格内依次填上所需的装置和试剂(可不填满)
| 装置 |
该装置中反应的离子方程式 |
| |
|
| |
|
| |
|
| |
|
为验证氧化性:Cl2>Fe3+>SO2,某小组用下图所示装置进行实验(夹持仪器和A中的加热装置已略,气密性已经检验完毕)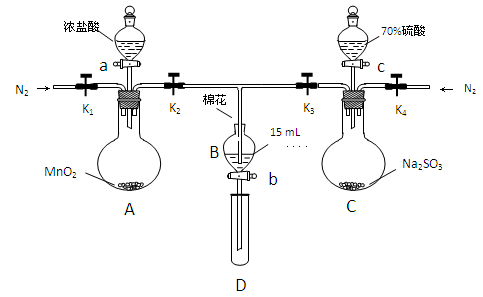
实验过程:
Ⅰ.打开弹簧夹K1-K4,通入一段时间N2,再将T型导管插入B中,继续通入N2,单后关闭K1、K2、K3 .
Ⅱ.打开活塞a,滴加一定量的浓盐酸,给A加热.
Ⅲ.当B中的溶液变黄时,停止加热,夹紧弹簧夹K2.
Ⅳ.打开活塞b,使约2ml的溶液流入D试管中,检验其中的离子.
Ⅴ.打开弹簧夹K3、活塞c,加入70%的硫酸,一段时间后夹紧弹簧夹K3.
Ⅵ.更新试管D,重复过程Ⅵ,检验B溶液中的离子.
(1)过程Ⅰ的目的是___________________________
(2)棉花中浸润的溶液为_______________________
(3)A中发生反应的化学方程式为_____________________________________________
(4)用70%的硫酸支取SO2,反应速率比用98%的硫酸块,原因是___________________
(5)过程Ⅳ中检验B溶液中是否含有硫酸根的操作是______________________________
(6)甲、乙、丙三位同学分别完成了上述实验,他们的检测结果一定能够证明氧化Cl2>Fe3+>SO2的是
| |
过程Ⅳ B溶液中含有的离子 |
过程Ⅵ B溶液中含有的离子 |
| 甲 |
有Fe3+无Fe2+ |
有SO42- |
| 乙 |
既有Fe3+又有Fe2+ |
有SO42- |
| 丙 |
有Fe3+无Fe2+ |
有Fe2+ |
(7)进行实验过程Ⅴ时,B中的溶液颜色由黄色变为红棕色,停止通气,放置一段时间后溶液颜色变为浅绿色。
查阅资料:Fe2+(aq)+SO32-(aq) 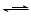 FeSO3(s)
FeSO3(s)
提出假设:FeCl3和SO2的反应经历了中间产物FeSO3,溶液的红棕色是FeSO3(墨绿色)与FeCl3(黄色)的混合颜色。
某同学设计如下实验,正式该假设的成立: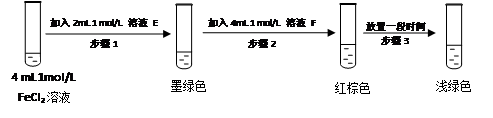
溶液E和F分别是___________、_______________
请用化学平衡原理解释步骤3红棕色溶液变为浅绿色的原因___________________________
某化学小组在学习元素周期律后,对教材中Fe2+氧化为Fe3+的实验进一步思考,并提出问题:Cl2能将Fe2+氧化为Fe3+,那么Br2和I2能否将Fe2+氧化为Fe3+?
环节一:理论推测
部分同学认为Br2和I2都可能将Fe2+氧化为Fe3+,他们思考的依据是________。
部分同学认为Br2和I2都不能将Fe2+氧化为Fe3+,还有同学认为Br2能将Fe2+氧化为
Fe3+而I2不能。他们思考的依据是从上到下卤素单质氧化性减弱。
环节二:设计实验进行验证
在大试管中加适量铁粉,加入10 mL稀盐酸,振荡试管,充分反应后,铁粉有剩余,取上层清液进行下列实验:。
实验1:
| 试管 |
操作 |
现象 |
| ① |
先向试管中加入2 mL FeCl2溶液,再滴加少量红棕色的溴水,振荡试管 |
溶液为黄色 |
| ② |
先向试管中加入2 mL FeCl2溶液,再滴加少量棕黄色的碘水,振荡试管 |
溶液为黄色 |
环节三:实验现象的分析与解释
(1)同学甲认为①中现象说明溴水能将Fe2+氧化,离子方程式为________。
同学乙认为应该补充实验,才能得出同学甲的结论。请你帮助同学乙完成实验:
实验2:
| 操作 |
应该观察到的现象 |
(2)该小组同学对②中溶液呈黄色的原因展开了讨论:
可能1:碘水与FeCl2溶液不反应,黄色是碘水稀释后的颜色。
可能2:______________。
实验3:进行实验以确定可能的原因。
| 操作 |
现象 |
| 向试管②所得溶液中继续加入0.5 mL CCl4,充分振荡,静置一段时间后。取出上层溶液,滴KSCN溶液 |
静置后,上层溶液几乎无色,下层溶液为紫色;上层溶液滴加KSCN溶液后,出现浅红色 |
同学丙认为该实验现象可以说明是“可能2”成立,同学丁认为不严谨,于是设计了实验4:
实验4:
| 操作 |
现象 |
| 向另一支试管中加入2 mL FeCl2溶液,滴加0.5 mL碘水后,再加入0.5 mL乙酸乙酯,充分振荡,静置一段时间后。取出下层溶液,滴加KSCN溶液 |
静置后,上层溶液为紫色,下层溶液几乎无色;下层溶液滴加KSCN溶液后,没有出现浅红色 |
你认为实验4设计的主要目的是________________。
同学丁根据实验4现象得出结论:在本次实验条件下,碘水与FeCl2溶液反应的程度很小。
(3)Cl2、Br2、I2氧化Fe2+的能力逐渐减弱,用原子结构解释原因:__________。
某小组同学为探究H2O2、H2SO3、Br2氧化性强弱,设计如下实验(夹持仪器已略去,装置的气密性已检验)。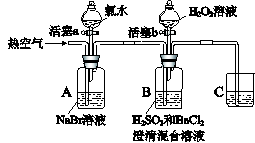
实验记录如下:
| |
实验操作 |
实验现象 |
| I |
打开活塞a,滴加氯水,关闭活塞a |
A中溶液变为红棕色。 |
| II |
吹入热空气 |
A中红棕色明显变浅;B中有气泡,产生大量白色沉淀,混合液颜色无明显变化。 |
| III |
停止吹入空气,打开活塞b,逐滴加入H2O2溶液 |
开始时颜色无明显变化;继续滴加H2O2溶液,一段时间后,混合液逐渐变成红棕色。 |
请回答下列问题:
(1)A中反应的离子方程式是 。
(2)实验操作II吹入热空气的目的是 。
(3)装置C的作用是 ,C中盛放的药品是 。
(4)实验操作III,混合液逐渐变成红棕色,其对应的离子方程式 。
(5)由上述实验得出的结论是 。
(6)实验反思:
①有同学认为实验操作II吹入的热空气,会干扰(5)中结论的得出,你认为是否干扰,理由是 。
②实验操作III,开始时颜色无明显变化的原因是(写出一条即可):
。
为验证氧化性Cl2>Fe3+>SO2,某小组用下图所示装置进行实验(夹持仪器和 A中加热装置已略)。
实验过程:
①检查装置气密性后,在各仪器中添加相应试剂。
②打开弹簧夹K1~K4,通入一段时间N2,再将T型导管插入B中,继续通入N2,然后关闭K1、K3、K4。
③打开活塞a,滴加一定量的浓盐酸,加热A。
④当B中溶液变黄时,停止加热,夹紧弹簧夹K2。
⑤打开活塞b,使约2mL的溶液流入D试管中,检验其中的离子。
⑥打开弹簧夹K3、活塞c,加入70%的硫酸,一段时间后夹紧弹簧夹K3。
⑦更换试管D,重复过程⑤,检验B溶液中的离子。
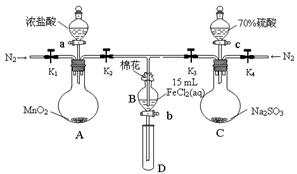
试回答下列问题:
(1)检验图中虚线框内装置气密性的具体操作是 。
(2)C中发生反应的化学方程式为 。
(3)B中的棉花通常会浸润 试剂;实验②中通入N2的作用是 。
(4)甲、乙、丙三位同学分别完成了上述实验,
他们的检测结果一定能够证明氧化性Cl2>Fe3+>SO2的是 (填“甲”、“乙”或“丙”)。
| |
过程⑤ B溶液中含有的离子 |
过程⑦ B溶液中含有的离子 |
| 甲 |
有Fe3+无Fe2+ |
有SO42- |
| 乙 |
既有Fe3+又有Fe2+ |
有SO42- |
| 丙 |
有Fe3+无Fe2+ |
有Fe2+ |
(5)进行实验过程⑥时,B中溶液颜色由黄色逐渐变为红棕色,停止通气,放置一段时间后溶液颜色变为浅绿色。
查阅资料:Fe2+(aq)+SO32-(aq) FeSO3(s)(墨绿色)
FeSO3(s)(墨绿色)
提出假设:FeCl3与 SO2的反应经历了中间产物FeSO3,溶液的红棕色是FeSO3(墨绿色)与FeCl3(黄色)的混合色。某同学设计如下实验,证实该假设成立: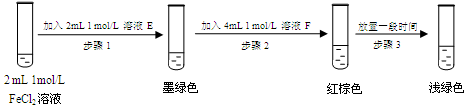
① 溶液E和F分别为 、 。
② 请用化学平衡原理解释步骤3中红棕色溶液颜色变为浅绿色的原因 。
Ⅰ.
(1)某兴趣小组甲设计了以下装置和方法测定空气中SO2含量。你认为可行的操作是 (填序号)
| 序号 |
A |
B |
C |
| 装置 |
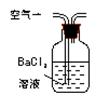 |
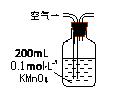 |
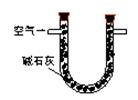 |
| 原理 |
通入V升空气,测定生成沉淀的质量 |
当KMnO4溶液刚好褪色时,测定通入空气的体积V |
通入V升空气,测定U型管增加的质量 |
(2)兴趣小组乙取336mL(标准状况)某由SO2和N2组成的混合气体Y,将其通入足量溴水中,然后加入足量BaCl2溶液,经适当操作后得干燥固体2.33g。由此推知气体Y中SO2的体积分数为
。
Ⅱ.某化学兴趣小组丙为探究Fe3+是否能氧化SO2,设计了如下实验装置。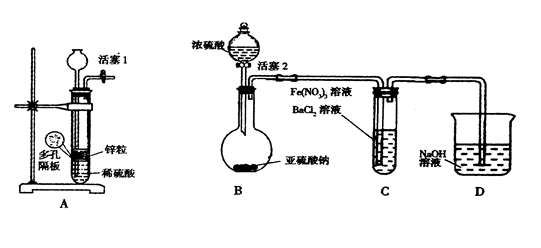
(1)如上图连接好装置。实验前应进行 操作
(2)观察到装置C中产生了白色沉淀,同学们提出了以下猜想(每个猜想只考虑一种物质的氧化性)。
猜想1: ;
猜想2:SO2被Fe3+氧化了;
猜想3:SO2被NO3—氧化了
(3)甲同学认为猜想1正确,并利用上述装置A进行了排除干扰的探究实验。
(4)乙同学认为猜想2正确,则装置C中反应的离子方程式是
(5)丙同学认为猜想3正确,他利用甲同学的实验装置,设计实验验证猜想。请在答题卡上写出实验步骤以及预期现象和结论。限选实验试剂:NaNO3溶液、KSCN溶液、FeCl3溶液、BaCl2溶液、
| 实验步骤 |
预期现象和结论 |
| |
|
Fe(NO3)3溶液
下列表示溶液中发生反应的化学方程式错误的是
| A.MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O |
| B.K2Cr2O7+6FeSO4+7H2SO4=Cr2(SO4)3+3Fe2(SO4)3+K2SO4+7H2O |
| C.2Al+2NaOH+2H2O=2NaAlO2+3H2↑ |
| D.2KMnO4+HCOOK+KOH=2K2MnO4+CO2↑+H2O |
某化学小组在学习元素周期律后,对教材中Fe2+氧化为Fe3+的实验进一步思考,并提出问题:Cl2能将Fe2+氧化为Fe3+,那么Br2和I2能否将Fe2+氧化为Fe3+?
环节一:理论推测
部分同学认为Br2和I2都可能将Fe2+氧化为Fe3+,他们思考的依据是 。
部分同学认为Br2和I2都不能将Fe2+氧化为Fe3+,还有同学认为Br2能将Fe2+氧化为Fe3+而I2不能。他们思考的依据是从上到下卤素单质氧化性减弱。
环节二:设计实验进行验证
在大试管中加适量铁粉,加入10 mL 稀盐酸,振荡试管,充分反应后,铁粉有剩余,取上层清液进行下列实验。
实验1:
| 试管 |
操作 |
现象 |
| ① |
先向试管中加入2 mL FeCl2溶液,再滴加少量红棕色的溴水,振荡试管 |
溶液为黄色 |
| ② |
先向试管中加入2 mL FeCl2溶液,再滴加少量棕黄色的碘水,振荡试管 |
溶液为黄色 |
环节三:实验现象的分析与解释
(1)同学甲认为①中现象说明溴水能将Fe2+氧化,离子方程式为 。
同学乙认为应该补充实验,才能得出同学甲的结论。请你帮助同学乙完成实验:
实验2:
| 操作 |
应该观察到的现象 |
| |
|
(2)该小组同学对②中溶液呈黄色的原因展开了讨论:
可能1:碘水与FeCl2溶液不反应,黄色是碘水稀释后的颜色。
可能2: 。
实验3:进行实验以确定可能的原因。
| 操作 |
现象 |
| 向试管②所得溶液中继续加入0.5 mLCCl4,充分振荡,静置一段时间后。取出上层溶液,滴加KSCN 溶液 |
静置后,上层溶液几乎无色,下层溶液为紫色;上层溶液滴加KSCN 溶液后,出现浅红色 |
同学丙认为该实验现象可以说明是“可能2”成立,同学丁认为不严谨,于是设计了实验4:
实验4:
| 操作 |
现象 |
| 向另一支试管中加入2 mL FeCl2溶液,滴加0.5mL碘水后,再加入0.5mL 乙酸乙酯,充分振荡,静置一段时间后。取出下层溶液,滴加KSCN 溶液 |
静置后,上层液为紫色,下层液几乎无色;下层溶液滴加KSCN溶液后,没有出现浅红色 |
你认为实验4设计的主要目的是 。
同学丁根据实验4现象得出结论:在本次实验条件下,碘水与FeCl2溶液反应的程度很小。
(3)Cl2、Br2、I2氧化Fe2+的能力逐渐减弱,用原子结构解释原因: 。
某研究小组对“Br2和I2能否将Fe2+氧化为Fe3+”这一课题进行实验和探究。请你完成相关问题的回答。
(1)提出合理的假设
假设1: Br2和I2都可以将Fe2+氧化为Fe3+;
假设2: Br2和I2都不能将Fe2+氧化为Fe3+;
假设3:
(2)实验验证
在大试管中加适量铁粉,加入10 mL 稀硫酸,振荡试管,充分反应后,铁粉有剩余,将所得的FeSO4溶液稀释到200mL,备用。
实验Ⅰ:向试管1中加入2 mL浅绿色的 FeSO4溶液,再滴加少量红棕色的溴水,振荡试管,溶液为黄色;
实验Ⅱ:向试管2中加入2 mL浅绿色的 FeSO4溶液,再滴加少量棕黄色的碘水,振荡试管,溶液为黄色。
(3)对实验现象的分析与讨论
①甲同学认为实验Ⅰ的现象说明溴水能将Fe2+氧化,离子方程式为 。
②乙同学认为应该补充实验,才能得出甲的结论。乙的实验操作以及预期现象是 。
③该小组同学对实验Ⅱ中溶液呈黄色的原因展开了讨论:
可能1:碘水与 FeSO4溶液不反应,黄色是碘水稀释后的颜色。
可能2: 。
丙同学和丁同学分别设计了以下实验方案以确定可能的原因。
丙方案:向试管2所得溶液中继续加入0.5mLCCl4,充分振荡,静置一段时间后。取出上层溶液,滴加几滴KSCN 溶液;
丁方案:向试管2所得溶液中继续加入加入0.5mL乙酸乙酯,充分振荡,静置一段时间后。取出下层溶液,滴加几滴KSCN 溶液;
你认为 方案为最佳方案,理由是 。
(4)拓展延伸
①为准确测定此实验所用的FeSO4溶液的浓度,某同学补充了以下实验:
滴定:量取20.00mL稀释后得到的溶液于锥形瓶中,将0.0200mol/LKMnO4标准溶液装入50mL中,滴定至终点,记录数据。重复滴定2次。平均消耗KMnO4溶液V mL。
②计算:此实验中所用的FeSO4溶液的物质的量浓度= mol/L(要求只列出算式,不需运算)。
(已知反应式:Fe2+ + MnO4- +H+ — Fe3+ + Mn2+ + H2O,未配平)
下列结论正确的是
①粒子半径:K+>Al3+>S2->Cl-
②氢化物的稳定性:HF>HCl>H2S>PH3>SiH4
③离子的还原性:S2->Cl->Br->I-
④氧化性:Cl2>S>Se>Te
⑤酸性:H2SO4>H3PO4>H2CO3>HClO
⑥非金属性:O>N>P>Si
⑦金属性:Be<Mg<Ca<K
| A.②⑤⑦ | B.②④⑥ |
| C.②④⑤⑥⑦ | D.②⑥⑦ |
某小组同学为比较酸性条件下NO3-、SO42-、Fe3+的氧化性强弱,设计如下实验(夹持仪器已略去,装置的气密性已检验)。
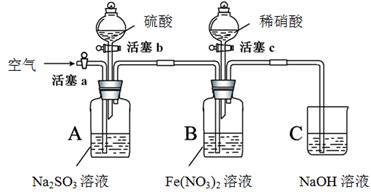
实验记录如下:
| |
实验操作 |
实验现象 |
| I |
打开活塞c,将过量稀HNO3加入装置B中,关闭活塞c |
B中浅绿色溶液立即变为深棕色;一段时间后,溶液最终变为黄色。 |
| II |
用注射器取出少量B装置中的溶液,加入KSCN溶液 |
溶液变为红色。 |
| III |
打开活塞b,向A装置中加入足量硫酸,关闭活塞b |
A中产生气体;B中有气泡,液面上有少量红棕色气体生成。 |
| IV |
一段时间后,用注射器取出少量B装置中的溶液,…… |
…… |
| V |
打开活塞a,通入一段时间空气 |
———— |
请回答下列问题:
(1)保存Fe(NO3)2溶液时,常加入铁粉,目的是(用化学方程式表示)________。
(2)实验I中,发生反应的离子方程式是________。
(3)资料表明,Fe2+能与NO结合形成深棕色物质[Fe(NO)]2+: Fe2+ + NO [Fe(NO)]2+
[Fe(NO)]2+
用平衡移动原理解释实验I中溶液由深棕色变为黄色的原因是________________________。
(4)分析实验现象,同学们得出了结论。则:
① 实验IV的后续操作是________________,观察到的现象是________________。
② 由实验得出的结论是_______________________。
(5)实验反思
① 实验操作V的目的是_______________________________________。
② 实验操作III,开始时B中溶液的颜色并无明显变化,此时溶液中发生反应的离子方程式是________。
③ 有同学认为装置中的空气会干扰实验结论的得出,应在实验前通一段时间的氮气。你是否同意该看法,理由是________________________________________。
试题篮
()