常温下,在下列溶液中发生如下反应: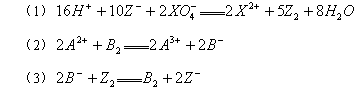
由此判断,下列说法错误的是
A.溶液中不可能发生反应 |
| B.Z2元素在(1)(3)反应中均做还原剂 |
C.氧化性由强到弱顺序是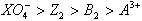 |
| D.X2+是XO4还原产物 |
根据下列实验事实:
(1)X+Y2+===X2++Y (2)Z+2H2O Z(OH)2+H2↑
Z(OH)2+H2↑
(3)Z2+的氧化性比X2+弱 (4)由Y、W作电极组成的原电池反应为:Y-2e-===Y2+
由此可知,X、Y、Z、W的还原性由强到弱的顺序是( )
| A.X>Y>Z>W | B.Y>X>W>Z | C.Z>X>Y>W | D.Z>Y>X>W |
已知:①硫酸比次氯酸稳定;②高氯酸是比硫酸更强的酸;③S2﹣易被氯气氧化;④氯化氢比硫化氢稳定;⑤稀盐酸不跟铜反应,浓硫酸能跟铜反应。上述叙述中可说明氯元素比硫元素非金属性强的是( )
| A.①②③ | B.②③④ | C.③④⑤ | D.①③⑤ |
金属镍有广泛的用途。粗镍中含有少量Fe、Cu、Pt等杂质,可用电解法制备高纯度的镍(用NiSO4作电解质溶液)。已知:氧化性Fe2+<Ni2+<Cu2+,下列叙述正确的是
| A.阳极发生还原反应,其电极反应式:Ni2+2e=Ni |
| B.电解过程中,阳极质量的减少与阴极质量的增加相等 |
| C.电解后,溶液中存在的金属阳离子只有Fe2+ |
| D.电解后,可以从电解槽底部的阳极泥中回收Cu和Pt |
氧化还原反应中,水的作用可以是氧化剂、还原剂、既是氧化剂又是还原剂、既非氧化剂又非还原剂等。下列反应与Br2+SO2+2H2O=H2SO4+2HBr相比较,水的作用不相同的是( )
| A.2Al+2NaOH+2H2O=2NaAlO2+3H2↑ |
| B.CaC2 + 2H2O→CH≡CH↑+ Ca(OH)2 |
| C.4Fe(OH)2+O2+2H2O=4Fe(OH)3 |
| D.2Na2O2+2H2O=4NaOH+O2↑ |
从海水中提取溴的过程中涉及到反应:Br2 + SO2 + 2H2O =" 2HBr" + H2SO4,下列说法正确的是
| A.Br2在反应中被氧化 |
| B.SO2在反应中表现还原性 |
| C.H2SO4是还原产物 |
| D.1 mol氧化剂在反应中失去2 mol电子 |
下列物质中,按只有氧化性、只有还原性、既有氧化性又有还原性的顺序排列的一组是( )
| A.F2、K、HCl | B.Cl2、Al、H2 |
| C.NO2、Na、Br2 | D.O2、SO2、H2O |
锰的化合物种类较多,也大多具有广泛的用途。
I.MnO2是H2O2分解的良好的催化剂,它也具有较强的氧化性。某化学兴趣小组通过实验探究MnO2的性质。
(1)该小组设计了如下4个方案以验证MnO2的氧化性,可行的是_____________。
A.把MnO2固体加入到稀盐酸中,观察是否有黄绿色气体生成
B.把MnO2固体加入到H2O2溶液中,观察是否有气泡产生
C.Na2 SO3溶液中,加入MnO2固体,再滴加BaCl2溶液,观察是否有白色沉淀生成
D.FeSO4溶液中滴加几滴KSCN溶液,再加入MnO2固体,观察溶液是否变红
(2)为研究溶液中MnO2的氧化能力与溶液酸碱性的关系,该小组同学设计了如下的对比实验:在
室温下,取A、B、C三支试管,用同浓度同体积的KI溶液和质量、颗粒大小相同的MnO2固体反应,然后分别加入1mL 0.2mol/L NaOH溶液、1mL水、1mL 0.1mol/L硫酸。现象记录如下:
| 试管编号 |
实验现象 |
| A |
溶液不变色 |
| B |
溶液缓慢变浅棕褐色 |
| C |
溶液迅速变棕褐色 |
从以上实验中,我们可以得出的结论是____________。
②写出C试管中发生反应的离子方程式:________________。
Ⅱ,铁酸锰( MnFe2O4)可用于热化学循环分解水制氢,可有效缓解能源危机。MnFe2O4的制备工艺流程如下图:
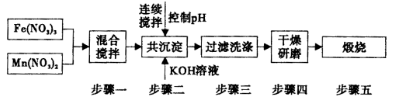
已知Fe3+、Mn2+沉淀的pH如表所示。
| |
开始沉淀 |
完全沉淀 |
| Fe3+ |
2.7 |
4.2 |
| Mn2+ |
8.3 |
10.4 |
①步骤一中投入原料Fe(NO3)3和Mn(NO3)2的物质的量之比理论上应为___________________。
②步骤二中需控制pH的范围是_______________
③步骤三中是否洗涤干净的判断方法是_____________.
已知Iˉ、Fe2+、SO2、Clˉ、H2O2均有还原性,它们在酸性溶液中还原性的强弱顺序为Clˉ< Fe2+< H2O2< Iˉ< SO2。则下列反应不能发生的是
| A.2Fe3++SO2+2H2O=2Fe2++SO42ˉ+4H+ |
| B.Cl2+SO2+2H2O=H2SO4+2HCl |
| C.H2O2+2H++ SO42ˉ=SO2↑+O2↑+2H2O |
| D.2I2+H2O2=2H2O+O2↑+4 Iˉ |
X、Z、Y、W 均为四种金属, 根据下列事实:①X+Y2+=X2++Y;②Z+2H2O(冷水)=Z(OH)2+H2↑;③Z2+的氧化性比X2+弱;④由Y、W电极组成的原电池,电极反应为W2++2e-=W、Y-2e-=Y2+,可知X、Y、Z、W的还原性由强到弱的顺序为 ( )
| A.X﹥Z﹥Y﹥W | B.Z﹥W﹥X﹥Y |
| C.Z﹥Y﹥X﹥W | D.Z﹥X﹥Y﹥W |
氢硫酸在空气中有如此反应:2H2S+O2==2S↓+2 H2O,下列不正确的是( )
| A.属于置换反应 | B.还原性:H2O> H2S |
| C.氧化性:O2> S | D.酸性:H2S> H2O |
反应①和②分别是从海藻灰和某种矿石中提取碘的主要反应:
①2NaI+MnO2+3H2SO4=2NaHSO4+MnSO4+2H2O+I2
②2NaIO3+5NaHSO3=2Na2SO4+3NaHSO4+H2O+I2。下列说法正确的是
| A.两个反应中均为硫元素被氧化 |
| B.碘元素在反应①中被还原,在反应②中被氧化 |
| C.氧化性:MnO2>SO42->IO3->I2 |
| D.反应①、②中生成等量的I2时转移电子数比为1︰5 |
试题篮
()