锰的化合物种类较多,也大多具有广泛的用途。
I.MnO2是H2O2分解的良好的催化剂,它也具有较强的氧化性。某化学兴趣小组通过实验探究MnO2的性质。
(1)该小组设计了如下4个方案以验证MnO2的氧化性,可行的是_____________。
A.把MnO2固体加入到稀盐酸中,观察是否有黄绿色气体生成
B.把MnO2固体加入到H2O2溶液中,观察是否有气泡产生
C.Na2 SO3溶液中,加入MnO2固体,再滴加BaCl2溶液,观察是否有白色沉淀生成
D.FeSO4溶液中滴加几滴KSCN溶液,再加入MnO2固体,观察溶液是否变红
(2)为研究溶液中MnO2的氧化能力与溶液酸碱性的关系,该小组同学设计了如下的对比实验:在
室温下,取A、B、C三支试管,用同浓度同体积的KI溶液和质量、颗粒大小相同的MnO2固体反应,然后分别加入1mL 0.2mol/L NaOH溶液、1mL水、1mL 0.1mol/L硫酸。现象记录如下:
| 试管编号 |
实验现象 |
| A |
溶液不变色 |
| B |
溶液缓慢变浅棕褐色 |
| C |
溶液迅速变棕褐色 |
从以上实验中,我们可以得出的结论是____________。
②写出C试管中发生反应的离子方程式:________________。
Ⅱ,铁酸锰( MnFe2O4)可用于热化学循环分解水制氢,可有效缓解能源危机。MnFe2O4的制备工艺流程如下图:
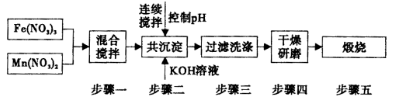
已知Fe3+、Mn2+沉淀的pH如表所示。
| |
开始沉淀 |
完全沉淀 |
| Fe3+ |
2.7 |
4.2 |
| Mn2+ |
8.3 |
10.4 |
①步骤一中投入原料Fe(NO3)3和Mn(NO3)2的物质的量之比理论上应为___________________。
②步骤二中需控制pH的范围是_______________
③步骤三中是否洗涤干净的判断方法是_____________.
(1)一个体重50kg的健康人含Fe元素约2g。主要以Fe2+、Fe3+形式存在于人体内。Fe2+易被吸收,给贫血者补充铁时,应补充含Fe2+的亚铁盐(如FeSO4)。服用Vitc,可使食物中的Fe3+转化为Fe2+。
①人体中经常进行Fe2+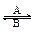 Fe3+的转化,在过程A中,Fe2+做 剂,过程B中Fe3+做 剂。
Fe3+的转化,在过程A中,Fe2+做 剂,过程B中Fe3+做 剂。
②Vitc使Fe3+转化为Fe2+,Vitc在这一过程中做 ,具有 性。
(2)写出下列反应的化学方程式,并注明氧化剂、还原剂
①“曾青得铁化为铜”: ;
②用CO还原Fe2O3炼铁: 。
用双线桥标出以下方程式中元素化合价变化、电子转移及数目并指出氧化剂还原剂。
(1)4Al + 3O2 ="=" 2Al2O3 (2)2H2O2 ="== " 2H2O + O2↑
根据反应(1)2P+5Br2+8H2O=2H3PO4+10HBr
(2)Cl2+2HBr=2HCl+Br2
(3)2KMn04+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O
推断氧化性(氧化剂)由强到弱的顺序是 。
还原性(还原剂)由强到弱的顺序是 。
(1)配平氧化还原反应方程式: C2O42-+ MnO4-+ H+= CO2+ Mn2++ H2O
(2)称取6.0 g含H2C2O4·2H2O、KHC2O4和K2SO4的试样,加水溶解,配成250mL溶液。量取两份此溶液各25mL,分别置于两个锥形瓶中。
①第一份溶液中加入酚酞试液,滴加0.25mol/LNaOH溶液至20mL时,溶液由无色变为浅红色。该溶液被中和的H+的物质的量为 mol。
②第二份溶液中滴加0.10mol/L的酸性高锰酸钾溶液至16mL时反应完全,此时溶液颜色由 变为 。该溶液中还原剂的物质的量为 mol。
氧化还原是常见的反应类型,根据信息回答以下问题: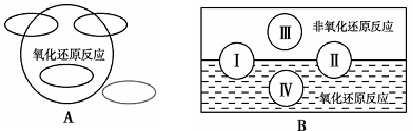
1、A图是“四种基本反应类型与氧化还原反应的关系”图,请在A图中用阴影部分表示反应:Cl2 + 2NaBr —→ 2NaCl + Br2 所属的区域。
2、“四种基本反应类型与氧化还原反应的关系”也可用B图表达。①其中Ⅰ为化合反应,则Ⅱ为 反应。②写出一个有水生成的符合反应类型Ⅲ的化学方程式: 。③写出一个有水参加的符合反应类型Ⅳ的化学方程式 ,
其中水作为 剂。(填氧化剂、还原剂等)
3、用“单线桥”分析下列氧化还原反应的电子转移方向及数目,并填空。
(1)2HClO —光→ 2HCl + O2↑ 氧化产物 被还原的元素
(2)2NaCl + 2H2O —电解→ 2NaOH + Cl2↑ + H2↑
4、有F-、Cl-、I-、Br2、I2五种粒子,其中氧化性最强的是 ,还原性最强的是 ,用离子方程式表示氧化性强弱的事实:
。
2001年1月6日,我国525名两院院士投票评选出1999年中国十大科技进步奖,其中一项是:储氢碳纳米管研究获重大进展。电弧法合成的碳纳米管,常伴有大量杂质——纳米颗粒。这种碳纳米颗粒可用氧化汽化法提纯。 其反应式是3C+2 K2Cr2O7+ 8H2SO4 3CO2↑+2K2SO4+2Cr2(SO4)3+8H2O
其反应式是3C+2 K2Cr2O7+ 8H2SO4 3CO2↑+2K2SO4+2Cr2(SO4)3+8H2O
(1)单线法标出电子转移的数目和方向。
(2)此反应的氧化剂是 氧化产物是 。
(3)H2SO4在上述反应中表现出来的性质是 (填选项编号)
| A.酸性 | B.氧化性 | C.吸水性 | D.脱水性 |
(4)上述反应中若产生0.1mol气体物质,则转移电子的物质的量是 mol.
多原子分子氰(CN)2、硫氰(SCN)2和(OCN)2的性质与卤素单质相似,故称它们为拟卤素。它们可以生成酸和盐(见下表,表中X代表F、Cl、Br或I)。
| |
卤素 |
氰 |
硫氰 |
① |
| “单质” |
X2 |
(CN)2 |
(SCN)2 |
(OCN)2 |
| 酸 |
HX |
HCN |
② |
HOCN |
| 盐 |
KX |
KCN |
KSCN |
③ |
(1)在表中①②③空格处应分别填写_______、 、_______。
(2)完成下列反应的化学方程式或离子方程式。
①(CN)2和KOH溶液反应的化学方程式为: 。
②已知阴离子的还原性强弱为:Cl-<Br-<CN—<SCN-<I-。试写出在NaBr和KSCN的混合溶液中加入(CN)2反应的离子方程式:____________________________________。
某化学反应的反应物和产物如下:
KMnO4 + KI+ H2SO4→ MnSO4 + I2 + KIO3 + K2SO4 + H2O
(1)该反应的氧化剂是 。
(2)如果该反应方程式中I2和KIO3的化学计量数都是5
①KMnO4的化学计量数是 。
②在下面的化学式上标出电子转移的方向和数目
KMnO4 + KI + H2SO4 →
(3)如果没有对该方程式中的某些化学计量数作限定,可能的配平化学计量数有许多组。原因是 。
某一反应体系中有反应物和生成物共五种物质:O2.H2CrO4.Cr(OH)3.H2O.H2O2。 已知该反应中H2O2只发生如下过程:H2O2―→O2
已知该反应中H2O2只发生如下过程:H2O2―→O2
(1)该反应中的还原剂是________。
(2)该反应中,发生还原反应的过程是________→________。
(3)写出该反应的化学方程式,并标出电子转移的方向和数目(用单线桥法)。
__________________________________________________________________
某反应中反应物与生成物有: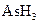 、
、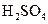 、
、 、
、 、
、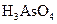 、Br2和。
、Br2和。
(1)配平上述化学反应方程式并标出电子转移的方向和数目: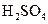 +
+ +
+ 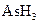 →
→ 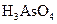 + Br2 +
+ Br2 +  + H2O
+ H2O
(2)反应中,被还原的元素是 ,还原剂是 。
(3)根据上述反应可推知 。
a.氧化性: b.氧化性:
b.氧化性:
c.还原性: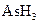 >Br2 d.还原性:
>Br2 d.还原性: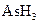 > Br2
> Br2
已知: ① 2FeCl3 + 2KI ="=" 2FeCl2 + 2KCl + I2, ② 2FeCl2+Cl2 ="==" 2FeCl3
根据①②两式判断各物质的氧化性由强到弱的顺序 。
| A.FeCl3 > Cl2 > I2 | B.Cl2 > FeCl3 > I2 | C.I2> Cl2 > FeCl3 | D.Cl2> I2> FeCl3 |
以下有水参与的化学反应都属于氧化还原反应,但水既不做氧化剂又不做还原剂的有 。
①2Na2O2+2H2O=4NaOH+O2↑ ②Cl2+H2O="HCl+HClO "
③C+H2O=CO+H2 ④3NO2+H2O=2HNO3+NO
⑤2Na+2H2O=2NaOH+H2↑ ⑥2F2+2H2O=4HF+O2
21在Fe + 2HCl ="=" FeCl2(氯化亚铁) + H2↑ 反应中。
② 此反应若转移了12mol的电子,则生成氢气 L(标准状况下).
试题篮
()