向FeI2溶液中不断通入Cl2,溶液中I-、I2、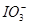 、Fe2+、Fe3+等粒子的物质的量随n(Cl2)∶n(FeI2)变化的曲线如图所示。
、Fe2+、Fe3+等粒子的物质的量随n(Cl2)∶n(FeI2)变化的曲线如图所示。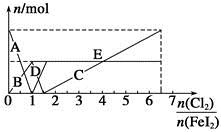
已知:2Fe3++2I-=I2+2Fe2+。
请回答下列问题:
(1)指出图中折线E和线段C所表示的意义:折线E表示 ;线段C表示 。
(2)写出线段D所表示的反应的离子方程式: 。
(3)当n(Cl2)∶n(FeI2)=6.5时,溶液中n(Cl-)∶n(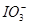 )= 。
)= 。
常温下,往H2O2溶液中滴加少量FeSO4溶液,可发生如下两个反应:
2Fe2++H2O2+2H+=2Fe3++2H2O 2Fe3++H2O2=2Fe2++O2↑+2H+ ,由此说明:
,由此说明:
(1)H2O2的氧化性比Fe3+ ,其还原性比Fe2+ (填“强”或“弱”) (2)
(2) 在H2O2分解过程中,FeSO4溶液 的作用是
在H2O2分解过程中,FeSO4溶液 的作用是
(每空1分,共11分)从下列各组反应对比,判断那种微粒的氧化性最强。
(1)铁钉浸入硫酸铜溶液中后,表面会附有红色物质,铜丝浸入硝酸银溶液后,表面会附有银白色物质。则铜、铁、银中,_____ ___原子的还原性最强;Cu2+、Ag+、Fe2+中, 离子的氧化性最强。
(2)在氯气中Fe锈蚀成棕褐色物质FeCl3,而在盐酸中生成淡绿色溶液FeCl2。则氯气分子、氢离子、氯离子中, 具有氧化性, 氧化性最强。请书写出以上各反应的化学方程式________ 、 。
(3)已知在ⅣA族元素中,Pb2+和Sn4+的化合物较为稳定。
①据此可判断PbO2具有较强的________性,SnCl2具有较强的 性;写出PbO2溶于盐酸的离子方程式__________;写出SnCl2和FeCl3溶液混合的离子方程式__________ ;
②PbO2、Fe3+、Cl2、Sn4+氧化性由强到弱的顺序是__________ 。
烟气的脱硫(除SO2)技术和脱硝(除NOx)技术都是环境科学研究的热点。
(1)烟气脱硫、脱硝的环境意义是 ;
(2)一种选择性催化脱硝(NO2)的原理为:6NO2+8NH3 7N2+12H2O
7N2+12H2O
①上述反应中被还原的元素是 (填元素符号),反应中每转移2.4mol电子,生成N2的物质的量为 。
②超音速飞机排放的尾气是平流层中NOx的主要来源.它们破坏臭氧层的主要机理为:
Ⅰ、O3 O+O2
O+O2
Ⅱ、NO+O3 →NO2+O2
Ⅲ、 NO2+O→NO+O2
上述反应中NO所起的作用是 ;
(3)下表列出了2种燃煤烟气脱硫方法的原理。
| 方法Ⅰ |
用氨水将SO2转化为NH4HSO3,再氧化成(NH4)2SO4 |
| 方法Ⅱ |
用生物质热解气(主要成分CO、CH4、H2)将SO2在高温下还原成单质硫 |
方法Ⅰ中用氨水吸收燃煤烟气中的SO2转化为NH4HSO3,写出该反应的离子方程式: ,是利用了SO2的 性质(选填字母编号)。
A.漂白性 B.氧化性 C.还原性 D.酸性氧化物
向盛有KI溶液的试管中加入少许CCl4后滴加氯水,CCl4层变成紫色。如果继续向试管中滴加氯水,振荡,CCl4层会逐渐变浅,最后变成无色。完成下列填空:
(1)写出并配平CCl4层由紫色变成无色的化学反应方程式 。
(2)整个过程中的还原剂是 。
(3)把KI换成KBr,则CCl4层变为 色;继续滴加氯水,CCl4层的颜色没有变化。Cl2、HIO3、HBrO3氧化性由强到弱的顺序是 。
(4)加碘盐中含碘量为20~50 mg·kg-1。制取加碘盐(含KIO3的食盐)1 000 kg,若用KI与Cl2反应制KIO3,至少需要消耗Cl2 L(标准状况,保留2位小数)。
有反应:
①2H2O+Cl2+SO2====H2SO4+2HCl
②2KMnO4+16HCl====2KCl+2MnCl2+5Cl2↑+8H2O
针对上述两个反应回答:
(1)两反应中的氧化剂的氧化性强弱顺序为 ,
还原剂的还原性强弱顺序为 。
(2)反应①中氧化产物和还原产物质量比为 。
已知氧化性BrO3->ClO3->Cl2>IO3->I2。现将饱和氯水逐滴滴入KI淀粉溶液中至过量。
(1)可观察到的现象是:
①___________________________________;②___________________________________;
(2)写出有关的离子方程式:
①__________________________________;②___________________________________;
过氧化氢H2O2(氧的化合价为-1价),俗名双氧水,医疗上利用它有杀菌消毒作用来清洗伤口。对于下列A~D涉及H2O2的反应,填写空白:
| A.Na2O2 +2HCl= 2NaCl+H2O2 |
| B.Ag2O+ H2O2=2Ag+O2+ H2O |
| C.2 H2O2="2" H2O+O2 |
| D.3 H2O2+Cr2(SO4)3+10KOH=2K2CrO4+3K2SO4+8 H2O |
(1)H2O2仅体现氧化性的反应是(填代号) 。
(2)H2O2既体现氧化性又体现还原性的反应是(填代号) 。
(3)B反应式中的氧化产物是 。
(4)上述反应说明H2O2、Ag2O、K2CrO4氧化性由强到弱的顺序是: 。
电解饱和食盐水的反应为2NaCl+2H2O Cl2↑+H2↑+2NaOH。
Cl2↑+H2↑+2NaOH。
27. 在上述方程式上标出电子转移的方向和数目。
28. 该反应中被氧化的元素是 。阴极产物之一为H2,阴极上发生的变化为 反应(选填“氧化”、“还原”)。
29. 电解产物氯气既能作氧化剂,也能作还原剂。下列反应中氯气只作氧化剂的是 (填写编号)。
a.Cl2+2KI→2KCl+I2 b.Cl2 + 2NaOH →NaCl + NaClO + H2O
c.CuCl2 Cl2↑+ Cu d.3Cl2 + 2Fe
Cl2↑+ Cu d.3Cl2 + 2Fe 2FeCl3
2FeCl3
)(1)2KClO3=2KCl+3O2↑ 是氧化剂, 是还原剂; 元素被氧化, 元素被还原; 是氧化产物, 是还原产物;并用双线桥法标出这个反应的电子转移方向和数目。
2KClO3=2KCl+3O2↑
(2)已知反应:
①MnO2+4HCl(浓)=MnCl2+Cl2↑+2H2O
②Cl2+SO2+2H2O=H2SO4+2HCl
1)两反应中的氧化剂的氧化性强弱顺序为 ;
2)反应②中氧化剂与还原剂的物质的量之比为 ;
3)反应①的离子方程式 ;
4)用174kg MnO2通过①②两反应可以处理SO2的质量为 。
某实验小组为探究ClO-、I2、SO42-在酸性条件下的氧化性强弱,设计实验如下:
实验①:在淀粉碘化钾溶液中加入少量次氯酸钠溶液,并加入少量的稀硫酸,溶液立即变蓝;
实验②:向实验①的溶液中加入4 mL 0.5 mol/L的亚硫酸钠溶液,蓝色恰好完全褪去。
(1)写出实验①中发生反应的离子方程式 。
(2)实验②中化学反应转移电子的物质的量是 。
(3)以上实验说明,在酸性条件下ClO-、I2、SO42-的氧化性由弱到强的顺序是_________________。
L、M、R、P、Q分别代表五种含不同化合价的氮元素的物质。A、B分别代表两种含不同化合价的氯元素的物质(每种物质中氮或氯元素的化合价只有一种)。又知物质M中的氮元素化合价要比物质Q中氮元素的化合价低。在一定条件下,它们会发生如下的转化(关系式未配平):
①P+A―→Q+B ②L+O2―→M+H2O ③L+M―→R+H2O ④B+H2O―→A+O2
(1)若五种含氮元素的物质中,有一种是硝酸,则硝酸是 ,理由是 。
(2)反应②必须在催化剂(铂、氧化铁等)作用下,加热到一定温度时方能发生,此反应在化工生产上有重要用途,据此推断在同温同压下,若物质R密度比空气的密度小,则R的化学式为 。
(3)某同学写出下面三个含氮的物质相互转换的关系式:
Ⅰ.M+P―→N2O3+H2O
Ⅱ.N2O4+H2O―→P+Q
Ⅲ.M+L―→Q+H2O
其中一定不可能实现的是 ,理由是 。
过氧化氢(H2O2,O的化合价为-1价)俗称双氧水,医疗上利用它有杀菌消毒作用来清洗伤口。研究下列涉及H2O2的反应,完成下列各题:
A.Ag2O+ H2O2=2Ag+O2 ↑+ H2O
B.3H2O2+Cr2(SO4)3+10KOH=2K2CrO4+3K2SO4+8H2O
(1)写出一个H2O2既体现氧化性又体现还原性的化学反应方程式 。
(2)将下列物质:H2O2、K2SO4、MnSO4、H2SO4、KMnO4、O2的化学式分别填在空白处组成一个不需配平的化学方程式: + +______ → + + + H2O
①该反应中的还原剂是 。
②该反应中,发生还原反应的元素是 。
(3)氧化性:KMnO4_____K2CrO4(填“>”或“<”)。
I(1)在淀粉碘化钾溶液中通入少量氯气,立即会看到溶液变蓝色,反应的离子方程式是 。
(2)在碘和淀粉形成的蓝色溶液中通入SO2气体,发现蓝色逐渐消失,反应的离子方程是 。
(3)对比(1)和(2)实验所得的结果,将Cl 、I
、I SO2按还原性由强到弱顺序排列为 。
SO2按还原性由强到弱顺序排列为 。
II .(4) 除去铁粉中混有铝粉的试剂是 ,离子方程式为
(5) 1mol过氧化钠与2mol碳酸氢钠固体混合后,在密闭容器中加热充分反应,排出气体物质后冷却,残留的固体物质是
(1)下列几种物质:①H2O、②Fe(OH)3胶体、③Mg、④蔗糖、⑤盐酸溶液、⑥Ca(OH)2、属于电解质的是 ,属于分散系的是 ;(用数字序号填空)
(2)含氧原子数相同的SO2和SO3的质量之比是 ,物质的量之比是 。
(3)已知: 2Fe3++2I-===2Fe2++I2,2Fe2++Br2===2Fe3++2Br-,Cl2+2Br-===2Cl-+Br2。 向含有1 mol FeI2和1mol FeBr2的溶液中通入2 mol Cl2,充分反应后,此时被氧化的离子是________;(填写离子符号),如果向上述原溶液中通入3 mol Cl2,充分反应后,此时所得溶液中含有的离子 。(填写离子符号,忽略水的电离)
试题篮
()