在酸性条件下:
①KBrO3能将KI氧化成I2或KIO3,其本身被还原成Br2;
②KIO3能将I-氧化为I2,也能将Br-氧化成Br2,其本身被还原成I2。
(1)上述反应所涉及到的粒子氧化性最强的是 (填离子符号);
(2)写出一个能证明氧化性Br2>I2的离子方程式 ;
(3)向含有KI、H2SO4的溶液中加入KBrO3溶液,若氧化产物、还原产物只有I2和Br2,写出反应的化学方程式,并标明电子转移方向和数目。
_______________________________________________________;
其中被氧化的元素是_________,要得到1mol还原产物转移电子数目为____________。
氧化一还原反应实际上是含氧化反应和还原反应二个过程,一个还原反应过程如下:NO3—+4H++ 3e— NO+ 2H2O
下列四种物质:KMnO4,Na2CO3,KI,Fe2(SO4)3中的一种物质甲,滴加少量稀硝酸,能使上述反应过程发生。
(1)被还原元素是______ ;还原剂是 ;
(2)写出并配平该氧化还原反应的化学方程式并用双线桥注明其电子转移的方向和数目: ;
(3)反应生成0.4mol H20,则转移电子的数目为 个;
(4)若反应后,氧化产物的化合价升高,而其他物质保持不变,则反应中氧化剂与还原剂物质的量之比将 (填“增大”、“不变”、“减小”或“不能确定”)
(CN)2、(OCN)2、(SCN)2等通称为拟卤素,它们的性质与卤素相似,氧化性强弱顺序是:(OCN)2>Cl2>(CN)2>(SCN)2>I2,写出下列反应的方程式
(1)(OCN)2 + KI
(2)AgCN
(3)(SCN)2 + H2O
过氧化氢H2O2(氧的化合价为-1价),俗名双氧水,医疗上利用它有杀菌消毒作用来清洗伤口。对于下列A~D涉及H2O2的反应,填写空白:
| A.Na2O2 +2HCl= 2NaCl+H2O2 |
| B.Ag2O+ H2O2=2Ag+O2+ H2O |
| C.2 H2O2="2" H2O+O2 |
| D.3 H2O2+Cr2(SO4)3+10KOH=2K2CrO4+3K2SO4+8 H2O |
(1)H2O2仅体现氧化性的反应是(填代号) 。
(2)H2O2既体现氧化性又体现还原性的反应是(填代号) 。
(3)B反应式中的氧化产物是 。
(4)上述反应说明H2O2、Ag2O、K2CrO4氧化性由强到弱的顺序是: 。
将32gCu与一定浓度的硝酸混合,二者正好完全反应。产生的NO2、NO混合气体在标准状况下的体积为11.2 L。
(1)分别写出Cu和HNO3反应过程的化学方程式:
,
(2)反应过程中被还原的硝酸的物质的量是 mol
在盛有淀粉KI溶液的试管中,滴加少量的NaClO溶液和稀H2SO4,会立即看到溶液变为蓝色,这是因为______________________________,相应的离子方程式为__________在盛有淀粉和碘水的混合液中,滴加Na2SO3溶液,发现__________________现象,这是因为________________________,其离子方程式为______________________________,对于上述两组实验的结果,可得出:ClO-、I2、SO42-的氧化性强弱顺序为___________________。
火药是中国的“四大发明”之一,永远值得炎黄子孙骄傲,也永远会激励着我们去奋发图强。黑火药在发生爆炸时,发生如下的反应:2KNO3+C+S=K2S+2NO2↑+CO2↑。其中被还原的元素是 ,被氧化的元素是 ,氧化剂是 ,还原剂是 ,氧化产物是 ,还原产物是 。
)(1)2KClO3=2KCl+3O2↑ 是氧化剂, 是还原剂; 元素被氧化, 元素被还原; 是氧化产物, 是还原产物;并用双线桥法标出这个反应的电子转移方向和数目。
2KClO3=2KCl+3O2↑
(2)已知反应:
①MnO2+4HCl(浓)=MnCl2+Cl2↑+2H2O
②Cl2+SO2+2H2O=H2SO4+2HCl
1)两反应中的氧化剂的氧化性强弱顺序为 ;
2)反应②中氧化剂与还原剂的物质的量之比为 ;
3)反应①的离子方程式 ;
4)用174kg MnO2通过①②两反应可以处理SO2的质量为 。
取一定量的酸性KMnO4溶液依次进行下列实验,有关现象记录如下:
①滴加适量H2O2,紫红色褪去,并有气泡产生;
②再加入适量的PbO2固体,固体溶解,溶液又变为紫红色;
③最后通入足量的SO2气体。
请回答下列问题:
(1)KMnO4、H2O2、PbO2氧化性由强到弱的顺序为 ;
(2)实验③中的现象为 。
(3)实验①、②中反应的离子方程式分别是 、 。
(1)已知:2Fe3++2I-===2Fe2++I2, 2Fe2++Br2===2Fe3++2Br-。
①根据以上方程式比较Fe2+、Br-、I-还原性的强弱
②含有1 mol FeI2和2 mol FeBr2的溶液中通入2 mol Cl2,此时被氧化的离子是________
(2)在硫酸铝、硫酸钾和明矾的1 L混合溶液中,如果SO42-浓度为0.4 mol/L,当加入等体积0.4 mol/L KOH溶液时,生成的沉淀恰好完全溶解,反应后混合溶液中K+的浓度为_______mol/L
某反应中反应物与生成物有:AsH3、H2SO4、KBrO3、K2SO4、H3AsO4、H2O和一种未知物质X。(As为砷元素)
 (1)已知KBrO3在反应中得到电子,则该反应的还原剂是 。
(1)已知KBrO3在反应中得到电子,则该反应的还原剂是 。 (2)已知0.2mol KBrO3在反应中得到1mol电子生成X,则X的化学式为 。
(2)已知0.2mol KBrO3在反应中得到1mol电子生成X,则X的化学式为 。 (3)根据上述反应可推知 。
(3)根据上述反应可推知 。 a.氧化性:KBrO3>H3AsO4 b.氧化性:H3AsO4> KBrO3
a.氧化性:KBrO3>H3AsO4 b.氧化性:H3AsO4> KBrO3 c.还原性:AsH3>X d.还原性:X > AsH3
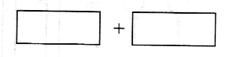
c.还原性:AsH3>X d.还原性:X > AsH3 (4)将氧化剂和还原剂的化学式及其配平后的系数填入下列方框中,并用单线桥标出电子转移的方
(4)将氧化剂和还原剂的化学式及其配平后的系数填入下列方框中,并用单线桥标出电子转移的方 向和数目:
向和数目:
将 分别含有MnO4—、Fe3+、Fe2+、I—的四种溶液混合,调节溶液的pH值,使pH=1,充分反应后:
分别含有MnO4—、Fe3+、Fe2+、I—的四种溶液混合,调节溶液的pH值,使pH=1,充分反应后:
(1)若I—离子有剩余,则上述四种离子在溶液中还存在的有 ,一定不存在的是 ;
(2)若所得混合液呈紫色,则上述四种离子在溶液中一定存在的有 ,一定不存在的离子有 ;
化学实验的微型化可有效地减少污染,实现化学实验绿色化的要求。某学生按下列操作做一个实验:在一块下衬白纸的玻璃片的不同位置分别滴加浓度为0.1 mol/L的KBr、KI(含淀粉溶液)、NaOH(含酚酞)、FeCl2(含KSCN)溶液各1滴,每种液滴彼此分开,围成半径小于表面皿的圆形(如下图所示),在圆心处放置2粒芝麻粒大小的KMnO4晶体,向KMnO4晶体滴加一滴浓盐酸,再立即将表面皿盖好。(e处反应的化学方程式为:2KMnO4+16HCl===2MnCl2+5Cl2↑+8H2O)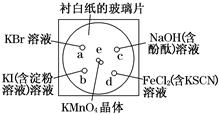
(1)e处反应中被氧化的HCl与参加反应的HCl的物质的量之比为 。
(2)b处的实验现象为___________________________________。
(3)c处反应的化学方程式为_____________________________________,标准状况下,当有0.224 L Cl2被NaOH溶液吸收后,转移电子的物质的量为 mol。
(4)通过该实验比较Cl2、FeCl3、KMnO4三种物质氧化性由强到弱的顺序是 。
试题篮
()