已知有如下反应:
①2BrO3-+Cl2=Br2+2ClO3-, ②ClO3-+5Cl-+6H+=3Cl2+3H2O,
③2FeCl3+2KI=2FeCl2+2KCl+I2, ④2FeCl2+Cl2=2FeCl3。
下列各微粒氧化能力由强到弱的顺序正确的是( )
| A.ClO3->BrO3->Cl2>Fe3+>I2 |
| B.BrO3->ClO3->Cl2>Fe3+>I2 |
| C.BrO3->ClO3->Fe3+>Cl2>I2 |
| D.BrO3->Cl2>ClO3->I2>Fe3+ |
根据下列反应判断有关的物质还原性由强到弱的顺序是( )
H2SO3+I2+H2O=2HI+H2SO4
2FeCl3+2HI=2FeCl2+2HCl+I2
3FeCl2+4HNO3=2FeCl3+NO↑+2H2O+Fe(NO3)3
| A.H2SO3>I->Fe2+>NO | B.I->Fe2+>H2SO3>NO |
| C.Fe2+>I->H2SO3>NO | D.NO>Fe2+>H2SO3>I- |
下列离子组在溶液中不能大量共存,但原因不是发生氧化还原反应的是
| A.Fe3+、NO3-、I-、K+ | B.H3O+、NO3-、Fe2+、Na+ |
| C.K+、Al3+、H+、MnO4- | D.Cu2+、NH4+、Br-、OH- |
交警测试司机是否酒后驾驶,30秒就能见分晓,酒精测试仪中用了CrO3,反应后转化为Cr2(SO4)3。则酒精在此过程中( )
| A.发生了氧化反应 | B.发生了还原反应 | C.表现了氧化性 | D.被还原 |
根据下列反应的化学方程式,判断有关物质的还原性强弱顺序是
I2+SO2+2H2O H2SO4+2HI 2FeCl2+Cl2
H2SO4+2HI 2FeCl2+Cl2 2FeCl3
2FeCl3
2FeCl3+2HI 2FeCl2+2HCl+I2
2FeCl2+2HCl+I2
| A.I->Fe2+>Cl->SO2 | B.Cl->Fe2+>SO2>I- |
| C.Fe2+>I->Cl->SO2 | D.SO2>I->Fe2+>Cl- |
根据下列反应判断氧化剂的氧化性由强到弱的顺序正确的是( )
①Cl2+2KI══I2+2KCl ②2FeCl3+2HI==I2+2FeCl2+2HCl
③2FeCl2+Cl2══2FeCl3 ④I2+SO2+2H2O══2HI+H2 SO4
SO4
| A.Cl2>I2>Fe3+>H2SO4 | B. Cl2>Fe3+>I2>H2SO4 Cl2>Fe3+>I2>H2SO4 |
| C.Fe3+>Cl2>I2>H2SO4 | D.Cl2>Fe3+>H2 SO4>I2 SO4>I2 |
“服用维生素C可使食物中的三价铁离子变成二价铁离子”这句话说明
| A.维生素C本身被还原 | B.维生素C具有还原性 |
| C.维生素C具有氧化性 | D.维生素C发生了还原反应 |
根据下列反应:(1)Ca(ClO)2+4HCl=CaCl2+2Cl2+2H2O
(2)2FeCl2+Cl2=2FeCl3 (3)2FeCl3+2KI=2FeCl2+KCl+I2
判断下列各物质的氧化性由强至弱的顺序正确的是
A、Ca(ClO)2>FeCl3>Cl2>I2 B 、Cl2> Ca(ClO)2> FeCl3>I2
、Cl2> Ca(ClO)2> FeCl3>I2
C、Ca(ClO)2>Cl2>FeCl3>I2 D、Ca(ClO)2>Cl2>I2>FeCl3 [来
氢化钙中的氢元素为-1价,它可用做生氢剂,反应的化学方程式是:
CaH2+2H2O==Ca(OH)2+2H2↑。该反应中,水的作用是. ( )
| A.溶剂 | B.还原剂 | C.氧化剂 | D.既是还原剂又是氧化剂 |
常温下,H2O2溶液中滴加少量FeSO4溶液,可发生如下反应:2Fe2++H2O2+2H+=2Fe3++2H2O,下列说法正确的是( )
| A.Fe2+得电子 | B.H2O2被氧化 |
| C.H2O2的氧化性比Fe3+强 | D.H2O既不是氧化产物也不是还原产物 |
下列反应能说明卤素非金属性活泼顺序是Cl>Br>I的是 ( )
①2HClO4+Br2(气) = 2HBrO4+Cl2 ②2NaBr+Cl2= 2NaCl+Br2
③2KI+Cl2= 2KCl+I2 ④2KI+Br2= 2KBr+I2
| A.①②③ | B.①②④ | C.②③④ | D.①②③④ |
已知反应①2BrO3- + Cl2 =Br2 +2ClO3-②5Cl2 + I2 +6H2O=2HIO3 +10HCl
③ClO3- +5Cl-+6H+=3Cl2 +3H2O,下列物质氧化能力强弱顺序正确的是( )
| A.ClO3->BrO3->IO3->Cl2 | B.BrO3->Cl2>C1O3->IO3- |
| C.BrO3->ClO3->Cl2>IO3- | D.Cl2>BrO3->C1O3->IO3- |
向NaBr、NaI、Na2SO3混合液中,通入—定量氯气后,将溶液蒸干并充分灼烧,得到固体剩余物质的组成可能是 ( )
| A.NaCl Na2SO4 | B.NaCl NaBr Na2SO4 |
| C.NaCl Na2SO4 I2 | D.NaCl NaI Na2SO4 |
已知:①向KMnO4晶体滴加浓盐酸,产生黄绿色气体;②向FeCl2溶液中通入少量实验①产生的气体,溶液变黄色;③取实验②生成的溶液滴在淀粉KI试纸上,试纸变蓝色。下列判断正确的是( )
A.上述实验证明氧化性:MnO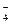 >Cl2>Fe3+>I2 >Cl2>Fe3+>I2 |
| B.实验①证明Cl—被还原 |
| C.实验①生成的气体不能使湿润的淀粉KI试纸变蓝 |
| D.实验③中氧化剂与还原剂的物质的量之比为2:1 |
试题篮
()