利用下图装置进行实验(必要时可加热),不能得出相应结论的是
| |
溶液① |
固体② |
溶液③ |
实验结论 |
 |
| A |
稀硫酸 |
Na2CO3 |
Na2SiO3 |
非金属性:C>Si |
|
| B |
浓盐酸 |
MnO2 |
Na2S |
氧化性:Cl2>S |
|
| C |
盐酸 |
CaCO3 |
C6H5ONa |
酸性:碳酸>苯酚 |
|
| D |
稀硫酸 |
Na2CO3 |
CaCl2 |
CO2不与氯化钙反应 |
下列变化中,必须使用氧化剂才能发生的是
| A.HC1→NaCl | B.SO2→S | C.Na→Na2O2 | D.NaHCO3→CO2 |
有A、B、C、D四种金属,将A与B用导线联结起来,浸入电解质溶液中,B不易被腐蚀;将A、D分别投入到等浓度的盐酸中,D比A反应剧烈;将铜浸入B的盐溶液中无明显变化;将铜浸入C的盐溶液中,有金属C析出。据此可推知它们的金属活动性由强到弱的顺序为
A.D>C>A>B B.D>A>B>C C.D>B>A>C D.B>A>D>C
常温下,在水溶液中发生如下反应
①16H++10C-+2XO4 - = 2X2++5C2+8H2O;②2A2++B2 = 2A3++2B-;③2B-+C2 = B2+2C-。下列说法错误的
| A.反应C2 + 2A2+ = 2A3+ + 2C- 可以进行 |
| B.还原性由强到弱的顺序是C->A2+>B->X2+ |
| C.氧化性由强到弱的顺序是XO4->C2>B2>A3+ |
| D.反应③是置换反应 |
仅用下表提供的玻璃仪器(非玻璃仪器任选)就能实现相应实验目的的是
| 选项 |
实验目的 |
玻璃仪器 |
| A |
分离乙醇和乙酸乙酯的混合物 |
分液漏斗、烧杯 |
| B |
用pH=1的盐酸配制100 mL,pH=2的盐酸 |
100 mL容量瓶、烧杯、玻璃棒、胶头滴管 |
| C |
用溴水、淀粉KI溶液比较Br2与I2的氧化性强弱 |
试管、胶头滴管 |
| D |
用NH4Cl固体和Ca(OH)2固体制备并收集NH3 |
酒精灯、烧杯、导管、集气瓶 |
已知常温下在溶液中可发生如下两个离子反应
Ce4++Fe2+ Fe3++Ce3+
Sn2++2Fe3+ 2Fe2++Sn4+
由此可以确定Fe2+、Ce3+、Sn2+三种离子的还原性由强到弱的顺序是
| A.Ce3+、Fe2+、Sn2+ | B.Sn2+、Ce3+、Fe2+ |
| C.Sn2+、Fe2+、Ce3+ | D.Fe2+、Sn2+、Ce3+ |
根据以下几个反应:
①Cl2+2KI 2KCl+I2 ②2FeCl2+Cl2
2KCl+I2 ②2FeCl2+Cl2 2FeCl3
2FeCl3
③2FeCl3+2KI 2FeCl2+2KCl+I2 ④I2+SO2+2H2O
2FeCl2+2KCl+I2 ④I2+SO2+2H2O H2SO4+2HI
H2SO4+2HI
判断还原性由强到弱的顺序是
| A.I->Fe2+>SO2 >Cl- | B.SO2>Fe2+>I-> Cl- |
| C.SO2>I ->Fe2+> Cl- | D.Fe2+>I->Cl->SO2 |
向含S2—、Fe2+、Br—、I—各0.1mol的溶液中通入Cl2,通入Cl2的体积(标准状况)和溶液中相关离子的物质的量关系图正确的是 :
下列实验操作与预期实验目的或所得实验结论一致的是
| 选项 |
实验操作 |
实验目的或结论 |
| A |
将NaOH溶液滴入该溶液中加热,放出的气体能使湿润的红色石蕊试纸变蓝 |
证明溶液中有NH4+ |
| B |
向某溶液中加入稀盐酸,放出无色刺激性气味气体,将气体通入澄清石灰水,石灰水变浑浊 |
证明该溶液中存在SO32- |
| C |
将Cl2通入品红溶液中,品红溶液褪色 |
证明Cl2的还原性 |
| D |
用硫酸酸化的H2O2溶液滴入Fe(NO3)2溶液中,溶液变黄色 |
证明氧化性:H2O2比Fe3+强 |
下述实验不能达到预期目的的是
| 选项 |
实验目的 |
实验方案 |
| A |
验证Ksp(AgCl)>Ksp(AgI) |
向NaCl溶液中滴加少量AgNO3溶液,产生白色沉淀,再滴加KI溶液,可观察到白色沉淀转化为黄色沉淀 |
| B |
检验Fe(NO3)2晶体是否已氧化变质 |
将Fe(NO3)2样品溶于稀H2SO4后,滴加KSCN溶液,观察溶液是否变红 |
| C |
验证Br2的氧化性强于I2 |
将少量溴水加入KI溶液中,再加入CCl4,振荡,静置。可观察到下层液体呈紫色 |
| D |
比较确定铜和镁的金属活动性强弱 |
用石墨作电极电解Mg(NO3)2、Cu(NO3)2的混合液 |
向FeI2、FeBr2的混合溶液中通入适量的氯气,溶液中某些离子的物质的量变化如下图所示。下列有关说法中正确的是
| A.离子的还原性顺序为:Fe2+>I->Br- |
| B.原混合溶液中FeBr2的物质的量为4mol |
| C.原溶液中:n(Fe2+)∶n(I-)∶n(Br-)=1∶2∶3 |
| D.当通入2 mol Cl2时,溶液中发生的离子反应可表示为:2Fe2++2I-+2Cl2=2Fe3++I2+4Cl- |
溴的氧化性介于氯和碘之间。利用这一性质判断,下列说法正确的是
| A.Cl—、I—离子加入到含Br—的溶液中,均可以将Br—氧化为Br2 |
| B.将Cl2缓慢通入含有相同物质的量浓度的Br—、I—的混合溶液中,Br—先被氧化 |
| C.湿润的淀粉碘化钾试纸遇到氯气会变蓝色 |
| D.在KBr溶液中加入碘水,发生如下反应:2Br—+I2=2I—+Br2 |
化学方程式可简明地体现元素及其化合物的性质。
已知:
下列说法不正确是:
| A.酸性(水溶液):HSCN〉H2CO3〉HCN |
| B.还原性(碱性溶液):Fe(OH)2〉I—〉KIO3 |
| C.热稳定性:NaCl〉NaClO4〉NaClO |
| D.氧化性(酸性溶液):I2〉FeCl3〉Co(OH)3 |
下列实验中,依据实验操作及现象,得出的结论正确的是
| |
操作 |
现象 |
结论 |
| A |
将水蒸气通过灼热的铁粉 |
粉末变红 |
铁与水在高温下发生反应 |
| B |
将充满NO2的密闭玻璃球浸泡在热水中 |
红棕色变深 |
反应2NO2(g) N2O4(g);ΔH<0 N2O4(g);ΔH<0 |
| C |
将少量的溴水分别滴入FeCl2溶液、NaI溶液中,再分别滴加CCl4振荡 |
上层分别呈无色和紫红色 |
还原性:I->Br->Fe2+ |
| D |
向溶液X中加入稀盐酸,并将产生的无色气体通入澄清石灰水中 |
生成白色沉淀 |
溶液X中一定含有CO32-或SO32- |
已知反应:①Cl2 + 2KBr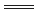 2KCl+Br2,②KClO3 +6HCl
2KCl+Br2,②KClO3 +6HCl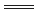 3Cl2+KCl +3H2O,
3Cl2+KCl +3H2O,
③2KBrO3 +Cl2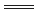 Br2 + 2KClO3,下列说法正确的是
Br2 + 2KClO3,下列说法正确的是
| A.上述三个反应都属于置换反应 |
| B.反应②中氧化剂与还原剂的物质的量之比为6∶1 |
| C.氧化性由强到弱顺序为 KBrO3>KClO3>Cl2>Br2 |
| D.反应③中若有lmol还原剂反应,则氧化剂得到电子的物质的量为2mol |
试题篮
()