从海水中提取溴的过程中涉及到反应:Br2 + SO2 + 2H2O =" 2HBr" + H2SO4,下列说法正确的是
| A.Br2在反应中被氧化 |
| B.SO2在反应中表现还原性 |
| C.H2SO4是还原产物 |
| D.1 mol氧化剂在反应中失去2 mol电子 |
根据下列实验事实:
(1)X+Y2+===X2++Y (2)Z+2H2O Z(OH)2+H2↑
Z(OH)2+H2↑
(3)Z2+的氧化性比X2+弱 (4)由Y、W作电极组成的原电池反应为:Y-2e-===Y2+
由此可知,X、Y、Z、W的还原性由强到弱的顺序是( )
| A.X>Y>Z>W | B.Y>X>W>Z | C.Z>X>Y>W | D.Z>Y>X>W |
金属镍有广泛的用途。粗镍中含有少量Fe、Cu、Pt等杂质,可用电解法制备高纯度的镍(用NiSO4作电解质溶液)。已知:氧化性Fe2+<Ni2+<Cu2+,下列叙述正确的是
| A.阳极发生还原反应,其电极反应式:Ni2+2e=Ni |
| B.电解过程中,阳极质量的减少与阴极质量的增加相等 |
| C.电解后,溶液中存在的金属阳离子只有Fe2+ |
| D.电解后,可以从电解槽底部的阳极泥中回收Cu和Pt |
已知:①硫酸比次氯酸稳定;②高氯酸是比硫酸更强的酸;③S2﹣易被氯气氧化;④氯化氢比硫化氢稳定;⑤稀盐酸不跟铜反应,浓硫酸能跟铜反应。上述叙述中可说明氯元素比硫元素非金属性强的是( )
| A.①②③ | B.②③④ | C.③④⑤ | D.①③⑤ |
氧化还原反应中,水的作用可以是氧化剂、还原剂、既是氧化剂又是还原剂、既非氧化剂又非还原剂等。下列反应与Br2+SO2+2H2O=H2SO4+2HBr相比较,水的作用不相同的是( )
| A.2Al+2NaOH+2H2O=2NaAlO2+3H2↑ |
| B.CaC2 + 2H2O→CH≡CH↑+ Ca(OH)2 |
| C.4Fe(OH)2+O2+2H2O=4Fe(OH)3 |
| D.2Na2O2+2H2O=4NaOH+O2↑ |
下列物质中,按只有氧化性、只有还原性、既有氧化性又有还原性的顺序排列的一组是( )
| A.F2、K、HCl | B.Cl2、Al、H2 |
| C.NO2、Na、Br2 | D.O2、SO2、H2O |
X、Z、Y、W 均为四种金属, 根据下列事实:①X+Y2+=X2++Y;②Z+2H2O(冷水)=Z(OH)2+H2↑;③Z2+的氧化性比X2+弱;④由Y、W电极组成的原电池,电极反应为W2++2e-=W、Y-2e-=Y2+,可知X、Y、Z、W的还原性由强到弱的顺序为 ( )
| A.X﹥Z﹥Y﹥W | B.Z﹥W﹥X﹥Y |
| C.Z﹥Y﹥X﹥W | D.Z﹥X﹥Y﹥W |
制备单质硅时,主要化学反应如下
①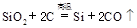 ②
② ③
③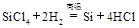 下列对上述三个反应的叙述中,不正确的是( )
下列对上述三个反应的叙述中,不正确的是( )
| A.①③为置换反应 | B.①②③均为氧化还原反应 |
| C.②为化合反应 | D.三个反应的反应物中硅元素均被氧化 |
甲乙两种非金属:①甲比乙容易与H2化合;②甲的氢化物比乙的氢化物稳定③
甲的最高价氧化物对应的水化物的酸性比乙的最高价氧化物对应的水化物酸性强;
④与某金属反应时甲原子得电子数目比乙的多;⑤甲的单质熔沸点比乙的低。能说
明甲比乙的非金属性强的是
| A.只要④ | B.只有⑤ | C.①②③④⑤ | D.①②③ |
下列变化必需加入氧化剂才能实现的是
| A.NH4+→NH3 | B.SO32-→SO42- | C.HNO3→NO | D.CO32-→CO2 |
氯和硫都是重要的非金属元素。下列叙述不能说明氯的非金属性比硫强的是
| A.氯化氢的沸点比硫化氢的沸点高 | B.与氢气反应时,氯气比硫更容易 |
| C.氯气可以从氢硫酸溶液中置换出硫 | D.高氯酸(HClO4)的酸性比H2SO4强 |
甲、乙两种非元素:①甲比乙容易与H2化合;②甲原子能与乙的阴离子发生置换反应;③甲的最高价氧化物对应的水化物酸性比乙的最高价氧化物对应的水化物酸性强;④与某金属反应时,甲原子得电子数目比乙的多;⑤甲的单质熔、沸点比乙的低。能说明甲比乙的非金属性强的是( )
| A.只有④ | B.只有⑤ | C.①②③ | D.①②③④⑤ |
根据下列三个反应,判断物质的氧化性由强到弱的顺序正确的是
①2Fe3++2I-=2Fe2++I2
②2Fe2++C12=2Fe3++2C1-
③2MnO4-+10Cl-+16H+=2Mn2++5Cl2↑+8H2O
| A.Fe3+>C12>MnO4- | B.Fe3+>Cl2>I2 |
| C.I2>Cl2>Fe3+ | D.MnO4->Cl2>Fe3+ |
试题篮
()