下列溶液中的c (Cl -)与50mL 1mol·L-1氯化铝溶液中的c (Cl -)相等的是 ( )
| A.150mL1mol·L-1氯化钠溶液 | B.75mL2mol·L-1氯化铵溶液 |
| C.150mL3mol·L-1氯化钾溶液 | D.75mL2mol·L-1氯化钡溶液 |
若用HAc表示醋酸,则在0.1mol·L-1 NaAc溶液中,下列离子浓度关系正确的是
| A.c(Na+)=c(Ac—)+c(HAc) |
| B.c(Na+)+c(OH—)= c(Ac—)+c(H+) |
| C.c(Na+)>c(OH—) > c(Ac—) > c(H+) |
| D.c(Na+)> c(Ac—)> c(H+)> c(OH—) |
pH=2的强酸溶液,加水稀释,若溶液体积扩大10倍,则C(H+)或C(OH-)的变化
| A.c(H+)和c(OH-)都减少 | B.c(H+)增大 | C.c(OH-)减小 | D.c(H+)减小 |
某氨水pH=x,某盐酸pH=y,已知x+y=14。将上述氨水、盐酸等体积混合后,所得溶液中各种离子浓度由大到小的顺序是( )
| A.C(NH4+)>C(Cl-)>C(OH-)>C(H+) | B.C(Cl-)>C(NH4+)>C(H+)>C(OH-) |
| C.C(Cl-)=C(NH4+)>C(OH-)=C(H+) | D.C(Cl-)=C(NH4+)>C(OH-)>C(H+) |
25℃时,向纯水中加入NaOH,使溶液的pH=11,则由NaOH电离出的OH-离子浓度与水电离的OH-离子浓度之比为( )
| A.1010:1 | B.5×109:1 | C.108:1 | D.1:1 |
下列溶液中微粒浓度关系一定正确的是
| A.氨水与氯化铵的pH=7的混合溶液中: c(Cl—)>c(NH4+) |
| B.pH=2的一元酸和pH=12的一元碱等体积混合:c(OH—)=c(H+) |
| C.0.1 mol·L-1的硫酸铵溶液中: c(NH4+)> c(SO42—)> c(H+) |
| D.0.1 mol·L-1的硫化钠溶液中:c(OH—)=c(H+)>c(HS—)> c(H2S) |
下列溶液中的Cl—浓度与50mL1 mol/L的AlCl3溶液中的Cl—浓度相等的是( )
| A.150ml 1mol/L的NaCl溶液 | B.50ml 3mol/L的 NaCl溶液 |
| C.150ml 3mol/L 的MgCl2溶液 | D.75ml 2mol/L的KCl溶液 |
用惰性电极电解下列溶液,一段时间后,再加入一定质量的另一物质中(括号内),溶液能与原来溶液完全一样的是
| A.CuSO4 [Cu(OH)2] | B.NaOH [NaOH] | C.NaCl [盐酸] | D.AgNO3 [Ag2O] |
25℃时,向1 mL pH=1的硫酸中滴加的10 mL pH= b的NaOH溶液,形成的混合溶液成碱性则b可能为 ( )
| A.10 | B.11 | C.12 | D.13 |
现有常温下的六份溶液:①0.01mol/LCH3COOH溶液;②0.01mol/LHCl溶液;③pH=12的氨水;④pH=12的NaOH溶液;⑤0.01mol/LCH3COOH溶液与pH=12的氨水等体积混合后所得溶液;⑥0.01mol/LHCl溶液与pH=12的NaOH溶液等体积混合所得溶液。
⑴其中水的电离程度最大的是 (选填序号,下同),水的电离程度相同的是 ;
⑵若将②、③混合后所得溶液pH=7,则消耗溶液的体积:② ③(选填“>”、“<”或“=”);
⑶将六份溶液稀释相同倍数后,溶液的pH:① ②,③ ④,⑤ ⑥(选填“>”、“<”或“=”);
⑷将①、④混合,若有c(CH3COO-)>c(H+),则混合液可能呈 (填序号)
A.酸性 B.碱性 C.中性
已知水在25℃和95℃时,其电离平衡曲线如右图所示: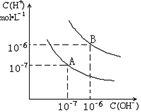
(1)25时,将=9的NaOH溶液与=4的溶液混合,混合所得溶液的=7,则NaOH溶液与溶液的体积比为
(2)95时,若100体积1=的某强酸溶液与1体积2=b的某强碱溶液混合后溶液呈中性,则混合前,该强酸的1与强碱的2之间应满足的关系是
(3)95时,pH=2的某HA溶液和pH=10的NaOH溶液等体积混合后,混合溶液的pH=5 ,则HA是 (填“强酸”或“弱酸”)
(5分)某二元酸(化学式用H2A表示)在水中的电离方程式是:
H2A====H++HA;HA-?H++A2-回答下列问题:
(1)在0.1mol·L-1的Na2A溶液中,下列微粒浓度关系式正确的是:——。
A.c(A2-)+c(HA-)+c(H2A)=0.1mol·L-1 B.c(OH-)=c(H+)+c(HA-)
C.c(Na+)+c(H+)==c(oH-)+c(HA-)+2c(A2-) D.c(Na+)=2c(A2-)+2c(HA-)
(2)已知0.1mol·L-1NaHA溶液的pH=2,则0.1mol·L-1 H2A溶液中氢离子的物质的量浓度可能
是 0.11 mol·L-1 (填“<”,“>”,或“=”),理由是:
常温下,取浓度相同的NaOH和HCI溶液,以体积比3:2相混合,所得溶液的pH等于12,则原溶液的浓度为
| A.0.01mol/L | B. 0.017mol/L |
| C.0.05mol/L | D.0.50mol/L |
试题篮
()