已知乙酸(HA)的酸性比甲酸(HB)弱,在物质的量浓度均为0.1 mol·L-1的NaA和NaB混合溶液中,下列排序正确的是
A.c(OH-)>c(HA)>c(HB)>c(H+) B.c(OH-)>c(A-)>c(B-)>c(H+)
C.c(OH-)>c(B-)>c(A-)>c(H+) D.c(OH-)>c(HB)>c(HA)>c(H+)
室温下,对于0.10 mol·L-1的氨水,下列判断正确的是
| A.与AlCl3溶液发生反应的离子方程式为Al3++3OH-===Al(OH)3↓ |
| B.加水稀释后,溶液中c(NH4+)·c(OH-)变大 |
| C.用HNO3溶液完全中和后,溶液不显中性 |
| D.其溶液的pH=13 |
常温下,0.1 mol·L-1的NaHB溶液中c(H+)>c(OH-),下列关系中一定正确的是
| A.c(Na+)+ c(H+)= c(HB-)+ 2c(B2-) |
| B.c(H+)·c(OH-)= 10-14 |
| C.c(Na+)= c(B2-)+ c(HB-) |
| D.溶液的pH=1 |
如将pH=5的HCl溶液稀释1000倍,溶液的pH为多少
| A.pH接近于8但比8小 | B.pH接近于7但比7小 |
| C.pH接近于6但比6小 | D.pH接近于5但比5小 |
某温度时,测得纯水中c(H+)=2.4×10-7 mol·L-1,则c(OH-)为
| A.2.4×10-7 mol·L-1 | B.1.0×10-7 mol·L-1 |
C. mol·L-1 mol·L-1 |
D.无法确定 |
关于水的离子积常数,下列说法不正确的是
| A.蒸馏水中,c(H+)·c(OH-)=1×10-14 |
| B.纯水中,25℃时,c(H+)·c(OH-)=1×10-14 |
| C.25℃时,任何以水为溶剂的稀溶液中,c(H+)·c(OH-)=1×10-14 |
| D.KW值随温度升高而增大 |
下列说法正确的是
| A.HCl溶液中无OH- |
| B.NaOH溶液中无H+ |
| C.NaCl溶液中既无OH-也无H+ |
| D.常温下,任何物质的水溶液中都有H+和OH-,且KW=1×10-14 |
下列溶液一定是碱性的是
| A.pH=8的某电解质的溶液 | B.c(OH-)>1×10-7mol/L |
| C.溶液中含有OH- | D.溶液中c(OH-)>c(H+) |
25°C时,水的电离达到平衡:H2O H++OH-,下列叙述正确的是
H++OH-,下列叙述正确的是
| A.将纯水加热到950C时,Kw变大,pH不变,水仍呈中性 |
| B.向纯水中加入稀氨水,平衡逆向移动,c(OH-)增大,Kw变小 |
| C.向水中加入少量固体硫酸氢钠,c(H+)增大,平衡逆向移动,KW不变 |
| D.向水中通入HCl气体,平衡逆向移动,溶液导电能力减弱 |
下列有关实验的说法正确的是
| A.中和滴定时,用待测溶液润洗锥形瓶 |
| B.使用pH试纸测定溶液pH时先润湿,则测得溶液的pH一定偏小 |
| C.用酸式滴定管量取12.00 mL高锰酸钾溶液 |
| D.在配制的硫酸亚铁溶液常加入一定量的铁粉和盐酸 |
25 ℃时,水的电离达到平衡:H2O 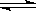 H++ OH- ;下列叙述正确的是
H++ OH- ;下列叙述正确的是
| A.向水中加入稀氨水,平衡逆向移动,c(OH-)降低 |
| B.向水中加入少量固体硫酸氢钠,c(H+)增大,Kw不变 |
| C.向水中加入少量固体NaOH ,平衡正向移动,c(H+)降低 |
| D.将水加热,Kw增大,pH不变 |
用标准的盐酸滴定未知浓度的NaOH溶液,下列操作不会引起实验误差的是
| A.用蒸馏水洗净酸式滴定管后,装入标准盐酸进行滴定 |
| B.用蒸馏水洗净锥形瓶后,再用NaOH溶液润洗,后装入NaOH溶液进行滴定 |
| C.用碱式滴定管取10.00 mL NaOH溶液放入用蒸馏水洗净的锥形瓶中,再加入适量蒸馏水进行滴定 |
| D.用酚酞作指示剂滴至红色刚变无色时即停止加盐酸 |
试题篮
()