常温下某溶液中由水电离产生的c(H+)=1×10-9mol·L-1,则下列叙述正确的是
| A.pH值一定为5 | B.一定是酸溶液 |
| C.可能是强酸的酸式盐溶液 | D.pH值可能为9 |
将0.2 mol·L-1HCOOH溶液加水稀释,下列说法正确的是( )
| A.溶液中c(H+)和c(OH-)都减小 | B.溶液中c(H+)增大 |
| C.醋酸电离平衡向左移动 | D.溶液的pH增大 |
下列溶液一定是碱性的是 ( )
| A.pH=6的某电解质的溶液 | B.c(OH-)>1×10-7mol/L |
| C.溶液中含有OH- | D.溶液中c(OH-)>c(H+) |
常温下,0.2 mol/L的一元酸HA与等浓度的NaOH溶液等体积混合后,所得溶液中部分微粒组分及浓度如图所示,下列说法正确的是( )

| A.HA为强酸 | B.该混合液pH=7 |
| C.图中X表示HA,Y表示OH-,Z表示H+ | D.该混合溶液中:c(A-)+c(Y)=c(Na+) |
常温下,向20 mL某浓度的盐酸中逐滴加入0.1 mol/L的氨水,溶液pH的变化与加入氨水的体积关系如图所示。
下列叙述正确的是
| A.盐酸的物质的量浓度为l mol/L |
| B.在①、②之间的任意一点:c(Cl-)>c(NH4+),c(H+)>c(OH-) |
| C.在点②所示溶液中:c(NH4+)=c(Cl-)>c(OH-)=c(H+),且V<20 |
| D.在点③所示溶液中:由水电离出的c(OH-)>l0-7mol/L |
氮元素能形成多种多样的化合物.请回答:
(1)298K时,在2L固定体积的密闭容器中,发生可逆反应:2NO2(g) N2O4(g)△H=﹣a kJ/mol (a>0).N2O4的物质的量浓度随时间变化如图1.达平衡时,N2O4的浓度为NO2的2倍,回答下列问题:
N2O4(g)△H=﹣a kJ/mol (a>0).N2O4的物质的量浓度随时间变化如图1.达平衡时,N2O4的浓度为NO2的2倍,回答下列问题:

①298k时,该反应的平衡常数为 L•mol﹣1(精确到0.01);
②下列情况不能用来判断该反应是否处于平衡状态的是 ;
A.混合气体的密度保持不变; B.混合气体的颜色不再变化;C.混合气体的气体压强保持不变
③若反应在398K进行,某时刻测得n(NO2)=0.6mol、n(N2O4)=1.2mol,则此时v(正) v(逆)(填“>”、“<”或“=”).
(2)常温条件下,向100mL 0.1mol•L﹣1NH4HSO4溶液中滴加0.1mol•L﹣1NaOH溶液,得到的溶液pH与NaOH溶液体积的关系曲线如图2所示.试分析图中a、b、c、d、e五个点(该条件下硫酸第二步电离是完全的).
①a点溶液的pH 1(填“>”“<”或“=”);
②b点溶液中发生水解反应的离子是 ;
③c点溶液中各离子浓度由大到小的排列顺序为 ;
④d、e点对应溶液中,水电离程度大小关系是d e(填“>”、“<”或“=”).
氯酸钠(NaClO3)是无机盐工业的重要产品之一。
(1)工业上制取氯酸钠采用在热的石灰乳中通入氯气,然后结晶除去氯化钙后,再加入适量的 (填试剂化学式),过滤后即可得到。
(2)实验室制取氯酸钠可通过如下反应3C12+6NaOH 5NaC1+NaC1O3+3H2O
5NaC1+NaC1O3+3H2O
先往-5℃的NaOH溶液中通入适量C12,然后将溶液加热,溶液中主要阴离子浓度随温度的变化如右图所示,图中C表示的离子是 。
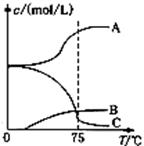
(3)某企业采用无隔膜电解饱和食盐水法生产氯酸钠。则反应化学方程式为: 。
(4)样品中C1O3-的含量可用滴定法进行测定,步骤如下:
步骤1:准确称取样品ag(约2.20g),经溶解、定容等步骤准确配制1000mL溶液。
步骤2:从上述容量瓶中取出10.00mL溶液于锥形瓶中,准确加入25mL 1.000mol/L (NH4)2Fe(SO4)2溶液(过量),再加入75mL硫酸和磷酸配成的混酸,静置10min。
步骤3:再在锥形瓶中加入100mL蒸馏水及某种指示剂,用0.0200mol/L K2Cr2O7标准溶液滴定至终点,消耗体积15.62mL。
步骤4: 。
步骤5:数据处理与计算。
①步骤2中反应的离子方程式为 ;静置10min的目的是 。
②步骤3中K2Cr2O7标准溶液应盛放在 (填仪器名称)中。
③为精确测定样品中C1O3-的质量分数,步骤4操作为 。
(5)在上述操作无误的情况下,所测定的结果偏高,其可能的原因的原因是 。
常温下,相同pH的氢氧化钠和醋酸钠溶液加水稀释,平衡时pH随溶液体积变化的曲线如下图所示,则下列叙述正确的是
| A.b、c两点溶液的导电能力相同 |
| B.a、b、c三点溶液中水的电离程度a>c>b |
| C.c点溶液中c (H+) = c (OH-) + c (CH3COOH) |
| D.用等浓度的盐酸分别与等体积的b、c处溶液恰好完全反应,消耗盐酸体积 Vb = Vc |
已知温度T时水的离子积常数为Kw,该温度下,将浓度为a mol/L的一元酸HA与bmol/L的一元碱BOH等体积混合,可判断溶液呈中性的依据是
| A.a = b |
| B.混合溶液中,c(H+) + c(B+) = c(OH-) + c(A-) |
C.混合溶液中,c(H+) =  |
| D.混合溶液的pH = 7 |
物质的量浓度相等的三种溶液:①H2CO3②NaOH③Na2CO3溶液,下列说法不正确的是
| A.水电离出的c(OH):③>①>② |
| B.溶液的pH:②>③>① |
| C.①和②等体积混合后的溶液:c(Na+)=c(H2CO3)+c(HCO3)+c(CO32-) |
| D.①和③等体积混合后的溶液:c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+) |
常温下,pH>7的某溶液中只含有Na+、CH3COO-、H+、OH-四种离子,下列描述正确的是
| A.该溶液只能由等物质的量浓度、等体积的氢氧化钠溶液和醋酸溶液混合而成 |
| B.该溶液一定由pH=3的醋酸溶液与pH=11的氢氧化钠溶液等体积混合而成 |
| C.该溶液中离子浓度一定为c(Na+)>c(CH3COO-)>c(OH-)>c(H+) |
| D.加入一定冰醋酸,c(CH3COO-)可能大于、等于或小于c(Na+) |
下列叙述正确的是
| A.某溶液的pH<7,说明该溶液一定呈酸性 |
| B.常温时pH = 3的盐酸溶液与pH = 5盐酸溶液等体积混合后溶液的pH = 4 |
| C.0.2 mol·L-1的盐酸,与等体积水混合后pH = 1 |
| D.常温时pH = 3的醋酸溶液,与pH = 11的氢氧化钠溶液等体积混合后pH = 7 |
有稀硫酸和稀盐酸的混合液10mL,在此溶液中滴入0.25 氢氧化钡溶液时(忽略溶液体积的变化),生成沉淀的量和溶液的pH变化与加入氢氧化钡溶液液体积的关系如右图所示。求:
氢氧化钡溶液时(忽略溶液体积的变化),生成沉淀的量和溶液的pH变化与加入氢氧化钡溶液液体积的关系如右图所示。求: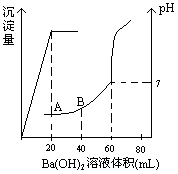
(1)滴定前盐酸和硫酸的物质的量浓度各为多少?
(2) 在B点时的pH是多少?(已知lg2=0.3)
(无计算过程不得分)
试题篮
()