为了配制 的浓度与Cl-的浓度比为1∶1的溶液,可在NH4Cl的溶液中加入( )
的浓度与Cl-的浓度比为1∶1的溶液,可在NH4Cl的溶液中加入( )
①适量的HCl ②适量的NaCl ③适量的氨水 ④适量的NaOH
| A.①② | B.③ | C.③④ | D.④ |
下列反应不属于水解反应或水解方程式不正确的是( )
①HCl+H2O H3O++Cl-
H3O++Cl-
②AlCl3+3H2O====Al(OH)3+3HCl
③Na2CO3+2H2O H2CO3+2NaOH
H2CO3+2NaOH
④碳酸氢钠溶液: +H2O
+H2O
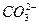 +H3O+
+H3O+
⑤NH4Cl溶于D2O中: +D2O
+D2O NH3·D2O+H+
NH3·D2O+H+
| A.①②③④ | B.①②③ |
| C.②③⑤ | D.全部 |
实验室在配制硫酸铁溶液时,先把硫酸铁晶体溶解在稀硫酸中,再加水稀释到所需的浓度,这样操作的目的是( )
| A.提高硫酸铁的溶解度 | B.防止硫酸铁分解 |
| C.降低溶液的pH | D.抑制硫酸铁水解 |
把0.2 mol·L-1NH4Cl溶液与0.1 mol·L-1NaOH溶液等体积混合后溶液中下列微粒的物质的量浓度的关系正确的是( )
A.c( )=c(Na+)=c(OH-)>c(NH3·H2O) )=c(Na+)=c(OH-)>c(NH3·H2O) |
B.c( )=c(Na+)>c(NH3·H2O)>c(OH-) )=c(Na+)>c(NH3·H2O)>c(OH-) |
C.c( )>c(Na+)>c(OH-)>c(NH3·H2O) )>c(Na+)>c(OH-)>c(NH3·H2O) |
D.c( )>c(Na+)>c(NH3·H2O)>c(OH-) )>c(Na+)>c(NH3·H2O)>c(OH-) |
在0.1 mol·L-1Na2CO3溶液中,各种微粒之间存在下列关系,其中不正确的是( )
A.c(Na+)+c(H+)=2c( )+c( )+c( )+c(OH-) )+c(OH-) |
B.c(Na+)=2[c( )+c( )+c( )+c(H2CO3)] )+c(H2CO3)] |
C.c(OH-)=c(H+)+c( )+2c(H2CO3) )+2c(H2CO3) |
D.c(Na+)=c( )=c(OH-)=c(H+) )=c(OH-)=c(H+) |
已知某溶液中只存在OH-、H+、 、Cl-四种离子,某同学推测其离子浓度大小顺序可能有如下四种关系:
、Cl-四种离子,某同学推测其离子浓度大小顺序可能有如下四种关系:
①c(Cl-)>c( )>c(H+)>c(OH-)
)>c(H+)>c(OH-)
②c( )>c(OH-)>c(Cl-)>c(H+)
)>c(OH-)>c(Cl-)>c(H+)
③c( )>c(Cl-)>c(OH-)>c(H+)
)>c(Cl-)>c(OH-)>c(H+)
④c(Cl-)>c(H+)>c( )>c(OH-)
)>c(OH-)
填写下列空白:
(1)若溶液中只溶解一种溶质,则该溶质是__________,上述四种离子浓度的大小顺序为__________(填序号)。
(2)若四种离子的关系符合③,则溶质为__________;若四种离子的关系符合④,则溶质为__________ 。
(3)将pH相同的NH4Cl溶液和HCl溶液稀释相同的倍数,下面图象正确的是__________(填图象符号)。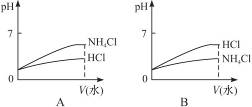

(4)若该溶液是由体积相等的稀盐酸和氨水混合而成,且恰好呈中性,则混合前c(HCl)___________c(NH3·H2O)(填“大于”“小于”或“等于”,下同);混合前酸中c(H+)和碱中c(OH-)的关系为c(H+)________c(OH-)。
(5)如右图所示,烧杯中盛放的溶液为盐酸,接通电流表G后,指针发生偏转,则负极材料是___________,正极反应式是______________。
25 ℃时,在浓度均为1 mol·L-1的(NH4)2SO4、(NH4)2SO3、(NH4)2Fe(SO4)2三种溶液中,若测得其中c( )分别为a、b、c(单位为mol·L-1),则下列判断正确的是( )
)分别为a、b、c(单位为mol·L-1),则下列判断正确的是( )
| A.a="b=c" | B.c>a>b | C.b>a>c | D.a>c>b |
常温下某一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合溶液的pH如下表:
| 实验编号 |
HA的浓度(mol·L-1) |
NaOH的浓度(mol·L-1) |
混合溶液的pH |
| 甲 |
0.2 |
0.2 |
pH=a |
| 乙 |
c |
0.2 |
pH=7 |
| 丙 |
0.2 |
0.1 |
pH>7 |
| 丁 |
0.1 |
0.1 |
pH=9 |
(1)不考虑其他组的实验情况,单从甲组分析如何用a来分析HA属于强酸还是弱酸:_____。
(2)不考虑其他组的实验情况,单从乙组分析c是否一定等于0.2?________。混合溶液中离子浓度c(A-)与c(Na+)的大小关系为________。
(3)从丙组结果分析HA是________酸,该混合溶液中离子浓度大小关系为________。
(4)丁组实验混合溶液中由水电离的c(OH-)=_____________mol·L-1。
常温下有浓度均为0.5 mol·L-1的四种溶液:①碳酸钠溶液②碳酸氢钠溶液③盐酸④氨水。请根据题目要求回答下列问题:
(1)上述溶液中,可发生水解反应的是___________(填序号,下同),在发生水解反应的溶液中pH最大的是____________________。
(2)上述溶液中,既能与氢氧化钠溶液反应,又能与硫酸溶液反应的是____________________。
(3)取适量溶液④,加入少量氯化铵固体,此时溶液中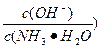 的值_________(填“增大”“减小”或“不变”)。
的值_________(填“增大”“减小”或“不变”)。
(4)将等体积的③和④的溶液混合后,所得溶液中离子浓度由大到小的顺序是___________。
(5)取10 mL溶液③,加水稀释到500 mL,则该溶液中由水电离出的c(H+)=______________。
已知H2O2、KMnO4、NaClO、K2Cr2O7均具有强氧化性,将溶液中的Cu2+、Fe2+、Fe3+沉淀为氢氧化物,需溶液的pH分别为6.4、6.4、3.7。现有含FeClx杂质的氯化铜晶体(CuCl2·2H2O),为制取纯净的CuCl2·2H2O,首先将其制成水溶液,然后按图示步骤进行提纯: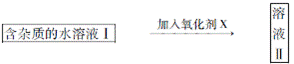
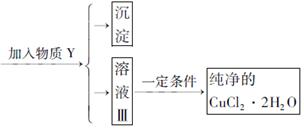
请回答下列问题:
(1)本实验最适合的氧化剂X是__________。(选填下面的序号)
| A.K2Cr2O7 | B.NaClO | C.H2O2 | D.KMnO4 |
(2)物质Y是________。
(3)本实验用加碱沉淀的目的是否能达到?________________。原因是________________。
(4)除去Fe3+的化学方程式为________________________________。
(5)加氧化剂的目的为________________________。
(6)最后能不能直接蒸发结晶得到CuCl2·2H2O晶体?________________。原因是________。
下列比较中,正确的是( )
| A.同温度同物质的量浓度时,HF比HCN易电离,则NaF溶液的pH比NaCN溶液大 |
| B.0.2 mol·L-1NH4Cl和0.1 mol·L-1NaOH溶液等体积混合后: c(  )>c(Cl-)>c(Na+)>c(OH-)>c(H+) )>c(Cl-)>c(Na+)>c(OH-)>c(H+) |
| C.物质的量浓度相等的H2S和NaHS混合溶液中: c(Na+)+c(H+)=c(S2-)+c(HS-)+c(OH-) |
D.同浓度的下列溶液中,①(NH4)2SO4、②NH4Cl、③CH3COONH4、④NH3·H2O;c( )由大到小的顺序是:①>②>③>④ )由大到小的顺序是:①>②>③>④ |
试题篮
()