(原创)常温下,0.1 mol/L CH3COONa溶液pH= 9,则下列说法正确的是
| A.加入少量NaOH固体后溶液pH小于9 |
| B.加水稀释,CH3COONa水解程度增大,c(OH-)增大 |
| C.该溶液水电离出的c(OH-)="=" 10-9 |
| D.CH3COOH在常温下Ka数值约为1×10-3 |
下列叙述Ⅰ和Ⅱ均正确并且有因果关系的是
| 选项 |
叙述Ⅰ |
叙述Ⅱ |
| A |
测得纳米材料Fe3O4的微粒直径为90nm |
纳米材料Fe3O4属于胶体 |
| B |
C(金刚石,s)===C(石墨,s) ΔH=-1.5 kJ·mol-1 |
相同条件下,石墨比金刚石稳定 |
| C |
NaHCO3溶液呈碱性 |
NaHCO3溶液中加入少量NaOH固体,可抑制HCO3-的水解,增大c(HCO3-) |
| D |
反应物比例不同可导致产物不同 |
Na与O2反应可能生成Na2O,也可能生成Na2O2 |
为了使K2S溶液中c(K+)/c(S2-)的比值变小,可加入的物质是
①适量HCl(g);②适量NaOH(s);③适量KOH(s);④适量NaHS(s);⑤适量的水
| A.②④ | B.①②⑤ | C.③④⑤ | D.②③ |
聚合硫酸铁(PFS)是水处理中重要的絮凝剂,如图是以回收废铁屑为原料制备PFS的一种工艺流程.
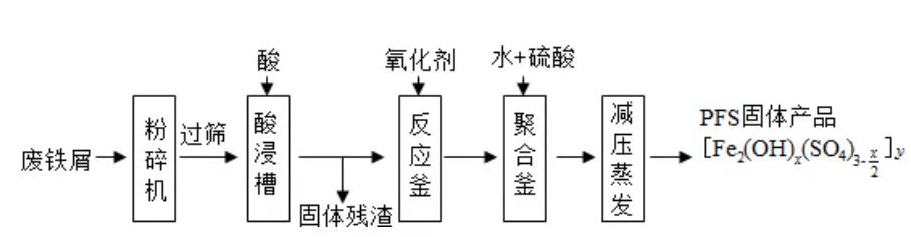
回答下列问题
(1)废铁屑主要为表面附有大量铁锈的铁,铁锈的主要成分为________.粉碎过筛的目的是________.
(2)酸浸时最合适的酸是________,写出铁锈与酸反应的离子方程式________.
(3)反应釜中加入氧化剂的作用是________,下列氧化剂中最合适的是________(填标号).
| A. |
|
B. |
|
C. |
|
D. |
|
(4)聚合釜中溶液的pH必须控制在一定的范围内,pH偏小时 水解程度弱,pH偏大时则________.
(5)相对于常压蒸发,减压蒸发的优点是________.
(6)盐基度B是衡量絮凝剂絮凝效果的重要指标,定义式为 (n为物质的量).为测量样品的B值,取样品 ,准确加入过量盐酸,充分反应,再加入煮沸后冷却的蒸馏水,以酚酞为指示剂,用 的标准NaOH溶液进行中和滴定(部分操作略去,已排除铁离子干扰).到终点时消耗NaOH溶液 .按上述步骤做空白对照试验,消耗NaOH溶液 ,已知该样品中Fe的质量分数w,则B的表达式为________.
对滴有酚酞试液的下列溶液,操作后颜色变深的是
| A.明矾[KAl(SO4)2·12H2O]溶液加热 |
| B.CH3COONa溶液加热 |
| C.氨水中加入少量NH4Cl |
| D.小苏打溶液中加入少量的NaCl固体 |
下列关于电解质溶液的叙述正确的是
| A.常温下,在NH4Cl溶液中离子浓度大小顺序为c(Cl—)>c(NH4+)>c(H+) > c(OH—) |
| B.将pH=4的醋酸溶液稀释后,溶液中所有离子的浓度均降低 |
| C.中和pH与体积均相同的盐酸和醋酸溶液,消耗NaOH的物质的量相同 |
| D.常温下,同浓度的Na2S与NaHS溶液相比,Na2S溶液的pH小 |
高纯硫酸锰作为合成镍钴锰三元正极材料的原料,工业上可由天然二氧化锰粉与硫化锰矿(还含Fe、Al、Mg、Zn、Ni、Si等元素)制备,工艺如下图所示。回答下列问题:
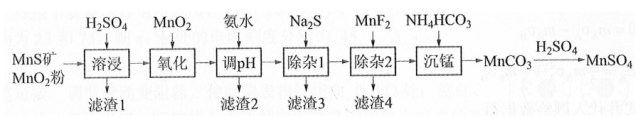
相关金属离子[ ]形成氢氧化物沉淀的pH范围如下:
| 金属离子 |
|
|
|
|
|
|
|
| 开始沉淀的pH |
8.1 |
6.3 |
1.5 |
3.4 |
8.9 |
6.2 |
6.9 |
| 沉淀完全的pH |
10.1 |
8.3 |
2.8 |
4.7 |
10.9 |
8.2 |
8.9 |
(1)"滤渣1"含有S和________;写出"溶浸"中二氧化锰与硫化锰反应的化学方程式________。
(2)"氧化"中添加适量的 的作用是将________。
(3)"调pH"除铁和铝,溶液的pH范围应调节为________~6之间。
(4)"除杂1"的目的是除去 和 , "滤渣3"的主要成分是________。
(5)"除杂2"的目的是生成 沉淀除去 。若溶液酸度过高, 沉淀不完全,原因是________。
(6)写出"沉锰"的离子方程式________。
(7)层状镍钴锰三元材料可作为锂离子电池正极材料,其化学式为 , 其中Ni、Co、Mn的化合价分别为+2、+3、+4。当 时, z=________。
代表阿伏伽德罗常数的值,下列说法正确的是()
| A. | 常温常压下, 中所含P-P键数目为 |
B. | 溶液中所含 的数目为 |
| C. | 标准状况下,11.2L甲烷和乙烯混合物中含氢原子数目为 |
D. | 密闭容器中, 和 催化反应后分子总数为 |
化学在生活中有着广泛的应用,下列对应关系错误的是( )
| |
化学性质 |
实际应用 |
| A |
和小苏打反应 |
泡沫灭火器灭火 |
| B |
铁比铜金属性强 |
腐蚀Cu刻制印刷电路板 |
| C |
次氯酸盐具有氧化性 |
漂白粉漂白织物 |
| D |
HF与 反应 |
氢氟酸在玻璃器皿上刻蚀标记 |
| A. | A |
B. | B |
C. | C |
D. | D |
化学与社会、生活密切相关,对下列现象或事实的解释正确的是( )
| 选项 |
现象或事实 |
解释或对应的方程式 |
| A |
用热的纯碱溶液洗去油污 |
CO32-+2H2O H2CO3+2OH- H2CO3+2OH-溶液呈碱性 |
| B |
酸雨样品在空气中放置pH减小 |
亚硫酸被氧化为硫酸2SO32-+O2=2SO42- |
| C |
“84”消毒液具有漂白性 |
2ClO-+CO2+H2O=2HClO+CO32- |
| D |
用加热法除去NaOH固体中混有的NH4Cl固体 |
NH4Cl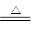 NH3↑+HCl↑ NH3↑+HCl↑ |
常温下,0.1mol/L的氯化铵溶液中,离子浓度最大的是
| A.Cl- | B.OH- | C.H+ | D.NH4+ |
试题篮
()