下列实验操作能达到实验目的的是( )
| A. |
用长颈漏斗分离出乙酸与乙醇反应的产物 |
| B. |
用向上排空气法收集铜粉与稀硝酸反应产生的 NO |
| C. |
配制氯化铁溶液时,将氯化铁溶解在较浓的盐酸中再加水稀释 |
| D. |
将 与 混合气体通过饱和食盐水可得到纯净的 |
对于下列实验,能正确描述其反应的离子方程式是( )
A.用Na2SO3溶液吸收少量Cl2:3SO32﹣+Cl2+H2O═2HSO3﹣+2Cl﹣+SO42﹣
B.向CaCl2溶液中通入CO2:Ca2++H2O+CO2═CaCO3↓+2H+
C.向H2O2溶液中滴加少量FeCl3:2Fe3++H2O2═O2↑+2H++2Fe2+
D.同浓度同体积NH4HSO4溶液与NaOH溶液混合:NH4++OH﹣═NH3•H2O
下列实验操作能达到实验目的是( )
| |
实验目的 |
实验操作 |
| A. |
制备Fe(OH) 3胶体 |
将NaOH浓溶液滴加到饱和FeCl 3溶液中 |
| B. |
由MgCl 2溶液制备无水MgCl 2 |
将MgCl 2溶液加热蒸干 |
| C. |
除去Cu粉中混有的CuO |
加入稀硝酸溶液,过滤、洗涤、干燥 |
| D. |
比较水与乙醇中氢的活泼性 |
分别将少量钠投入到盛有水和乙醇的烧杯中 |
| A. |
A |
B. |
B |
C. |
C |
D. |
D |
硼酸
是一种重要的化工原料,广泛应用于玻璃、医药、肥料等工艺。一种以硼镁矿(含
及少量
)为原料生产硼酸及轻质氧化镁的工艺流程如下:
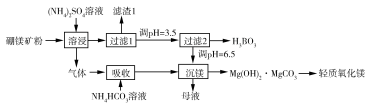
回答下列问题:
(1)在 "溶侵"硼镁矿粉,产生的气体在"吸收"中反应的化学方程式为_________。
(2)"滤渣1"的主要成分有_________。为检验"过滤1"后的滤液中是否含有 离子,可选用的化学试剂是_________。
(3)根据H3BO3的解离反应: , ,可判断 是_______酸;在"过滤2"前,将溶液pH调节至3.5,目的是_______________。
(4)在"沉镁"中生成 沉淀的离子方程式为__________,母液经加热后可返回___________工序循环使用。由碱式碳酸镁制备轻质氧化镁的方法是_________。
下列电离或离子方程式正确的是
A.亚硫酸的电离:H2SO3 2H++ SO32- 2H++ SO32- |
B.氯化铵水解的离子方程式为: NH4+ +H2O  NH3·H2O + H+ NH3·H2O + H+ |
C.NaHCO3水解的离子方程式为:HCO3-+H2O  CO32-+H3O+ CO32-+H3O+ |
D.向氯化铝溶液中加入过量的氨水:A13++3NH3·H2O Al(OH)3+3NH4+ Al(OH)3+3NH4+ |
是阿伏加德罗常数的值,下列说法正确的是( )
| A. |
16.25g 水解形成的 胶体粒子数为 |
| B. |
22.4L(标准状况)氩气含有的质子数为 |
| C. |
92.0g甘油(丙三醇)中含有羟基数为 |
| D. |
与 在光照下反应生成的 分子数为 |
磁选后的炼铁高钛炉渣,主要成分有 、 、 、 、 以及少量的 。为节约和充分利用资源,通过如下工艺流程回收钛、铝、镁等。
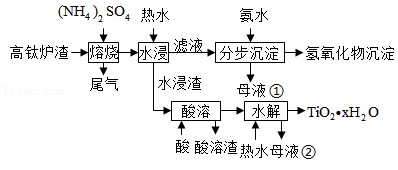
该工艺条件下,有关金属离子开始沉淀和沉淀完全的pH见下表
| 金属离子 |
|
|
|
|
| 开始沉淀的pH |
2.2 |
3.5 |
9.5 |
12.4 |
| 沉淀完全 的pH |
3.2 |
4.7 |
11.1 |
13.8 |
回答下列问题:
(1)"焙烧"中, 、 几乎不发生反应, 、 、 、 转化为相应的硫酸盐。写出 转化为 的化学方程式 。
(2)"水浸"后"滤液"的 约为2.0,在"分步沉淀"时用氨水逐步调节 至11.6,依次析出的金属离子是 。
(3)"母液①"中 浓度为 。
(4)"水浸渣"在 "酸溶",最适合的酸是 。"酸溶渣"的成分是 、 。
(5)"酸溶"后,将溶液适当稀释并加热, 水解析出 沉淀,该反应的离子方程式是 。
(6)将"母液①"和"母液②"混合,吸收尾气,经处理得 ,循环利用。
我国是世界上最早制得和使用金属锌的国家。一种以闪锌矿(ZnS,含有  和少量FeS、CdS、PbS杂质)为原料制备金属锌的流程如图所示:
和少量FeS、CdS、PbS杂质)为原料制备金属锌的流程如图所示:

相关金属离子  形成氢氧化物沉淀的pH范围如下:
形成氢氧化物沉淀的pH范围如下:

回答下列问题:
(1)焙烧过程中主要反应的化学方程式为________。
(2)滤渣1的主要成分出 外还有________;氧化除杂工序中ZnO的作用是________.若不通入氧气,其后果是________。
(3)溶液中的 可用锌粉除去,还原除杂工序中反应的离子方程式为________。
(4)电解硫酸锌溶液制备单质锌时,阴极的电极反应式为________;沉积锌后的电解液可返回________工序继续使用。
以酚酞为指示剂,用0.1000mol•L ﹣ 1的NaOH溶液滴定20.00mL未知浓度的二元酸H 2A溶液。溶液中,pH、分布系数δ随滴加NaOH溶液体积V NaOH的变化关系如图所示。[比如A 2 ﹣的分布系数:δ(A 2 ﹣) ]
下列叙述正确的是( )

A.曲线①代表δ(H 2A),曲线②代表δ(HA ﹣)
B.H 2A溶液的浓度为0.2000mol•L ﹣ 1
C.HA ﹣的电离常数K a=1.0×10 ﹣ 2
D.滴定终点时,溶液中c(Na +)<2c(A 2 ﹣)+c(HA ﹣)
聚合硫酸铁(PFS)是水处理中重要的絮凝剂,如图是以回收废铁屑为原料制备PFS的一种工艺流程.
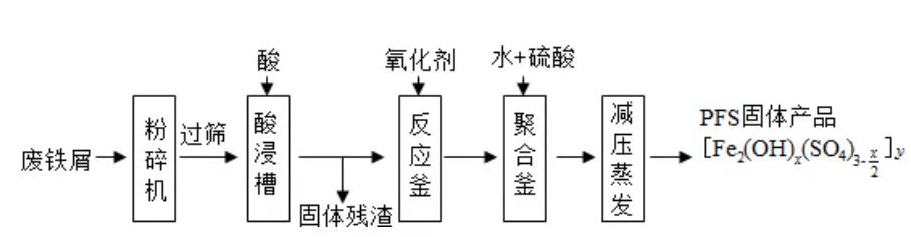
回答下列问题
(1)废铁屑主要为表面附有大量铁锈的铁,铁锈的主要成分为________.粉碎过筛的目的是________.
(2)酸浸时最合适的酸是________,写出铁锈与酸反应的离子方程式________.
(3)反应釜中加入氧化剂的作用是________,下列氧化剂中最合适的是________(填标号).
| A. |
|
B. |
|
C. |
|
D. |
|
(4)聚合釜中溶液的pH必须控制在一定的范围内,pH偏小时 水解程度弱,pH偏大时则________.
(5)相对于常压蒸发,减压蒸发的优点是________.
(6)盐基度B是衡量絮凝剂絮凝效果的重要指标,定义式为 (n为物质的量).为测量样品的B值,取样品 ,准确加入过量盐酸,充分反应,再加入煮沸后冷却的蒸馏水,以酚酞为指示剂,用 的标准NaOH溶液进行中和滴定(部分操作略去,已排除铁离子干扰).到终点时消耗NaOH溶液 .按上述步骤做空白对照试验,消耗NaOH溶液 ,已知该样品中Fe的质量分数w,则B的表达式为________.
高纯硫酸锰作为合成镍钴锰三元正极材料的原料,工业上可由天然二氧化锰粉与硫化锰矿(还含Fe、Al、Mg、Zn、Ni、Si等元素)制备,工艺如下图所示。回答下列问题:
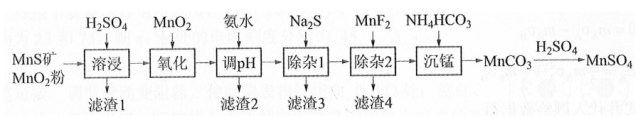
相关金属离子[ ]形成氢氧化物沉淀的pH范围如下:
| 金属离子 |
|
|
|
|
|
|
|
| 开始沉淀的pH |
8.1 |
6.3 |
1.5 |
3.4 |
8.9 |
6.2 |
6.9 |
| 沉淀完全的pH |
10.1 |
8.3 |
2.8 |
4.7 |
10.9 |
8.2 |
8.9 |
(1)"滤渣1"含有S和________;写出"溶浸"中二氧化锰与硫化锰反应的化学方程式________。
(2)"氧化"中添加适量的 的作用是将________。
(3)"调pH"除铁和铝,溶液的pH范围应调节为________~6之间。
(4)"除杂1"的目的是除去 和 , "滤渣3"的主要成分是________。
(5)"除杂2"的目的是生成 沉淀除去 。若溶液酸度过高, 沉淀不完全,原因是________。
(6)写出"沉锰"的离子方程式________。
(7)层状镍钴锰三元材料可作为锂离子电池正极材料,其化学式为 , 其中Ni、Co、Mn的化合价分别为+2、+3、+4。当 时, z=________。
下列离子方程式方程式中正确的是
A.NaHCO3溶液中HCO3-水解:HCO3-+ H2O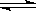 H2CO3+OH- H2CO3+OH- |
| B.AlCl3溶液中Al3+水解:Al3++3H2O = Al(OH)3↓+3H+ |
C.NaHS溶液中HS-水解:HS-+H2O 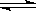 H3O++S2- H3O++S2- |
D.碳酸溶液中H2CO3的电离:H2CO3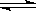 2H++ CO32- 2H++ CO32- |
代表阿伏伽德罗常数的值,下列说法正确的是()
| A. | 常温常压下, 中所含P-P键数目为 |
B. | 溶液中所含 的数目为 |
| C. | 标准状况下,11.2L甲烷和乙烯混合物中含氢原子数目为 |
D. | 密闭容器中, 和 催化反应后分子总数为 |
化学在生活中有着广泛的应用,下列对应关系错误的是( )
| |
化学性质 |
实际应用 |
| A |
和小苏打反应 |
泡沫灭火器灭火 |
| B |
铁比铜金属性强 |
腐蚀Cu刻制印刷电路板 |
| C |
次氯酸盐具有氧化性 |
漂白粉漂白织物 |
| D |
HF与 反应 |
氢氟酸在玻璃器皿上刻蚀标记 |
| A. | A |
B. | B |
C. | C |
D. | D |
试题篮
()